H2o углекислый газ co2. Физические и химические свойства углекислого газа. Примеры решения задач
8.1. Что такое химическая номенклатура
Химическая номенклатура складывалась
постепенно, в течение нескольких столетий. По
мере накопления химических знаний она
неоднократно менялась. Уточняется и развивается
она и сейчас, что связано не только с
несовершенством некоторых номенклатурных
правил, но еще и с тем, что ученые постоянно
открывают новые и новые соединения, назвать
которые (а бывает, что даже и составить формулы),
пользуясь существующими правилами иногда
оказывается невозможно. Номенклатурные правила,
принятые в настоящее время научным сообществом
всего мира, содержатся в многотомном издании: "
Номенклатурные правила ИЮПАК по химии" , число
томов в котором непрерывно возрастает.
С типами химических формул, а также с некоторыми
правилами их составления вы уже знакомы. А какие
же бывают названия химических веществ?
Пользуясь номенклатурными правилами, можно
составить систематическое
название
вещества.
Для многих веществ кроме систематических используются и традиционные, так называемые тривиальные названия. При своем возникновении эти названия отражали определенные свойства веществ, способы получения или содержали название того, из чего данное вещество было выделено. Сравните систематические и тривиальные названия веществ, приведенных в таблице 25.
К тривиальным относятся и все названия минералов (природных веществ, составляющих горные породы), например: кварц (SiO 2); каменная соль, или галит (NaCl); цинковая обманка, или сфалерит (ZnS); магнитный железняк, или магнетит (Fe 3 O 4); пиролюзит (MnO 2); плавиковый шпат, или флюорит (CaF 2) и многие другие.
Таблица 25. Систематические и тривиальные названия некоторых веществ
Систематическое название |
Тривиальное название |
|
| NaCl | Хлорид натрия | Поваренная соль |
| Na 2 CO 3 | Карбонат натрия | Сода, кальцинированная сода |
| NaHCO 3 | Гидрокарбонат натрия | Питьевая сода |
| CaO | Оксид кальция | Негашеная известь |
| Ca(OH) 2 | Гидроксид кальция | Гашеная известь |
| NaOH | Гидроксид натрия | Едкий натр, каустическая сода, каустик |
| KOH | Гидроксид калия | Едкое кали |
| K 2 CO 3 | Карбонат калия | Поташ |
| CO 2 | Диоксид углерода | Углекислый газ, углекислота |
| CO | Монооксид углерода | Угарный газ |
| NH 4 NO 3 | Нитрат аммония | Аммиачная селитра |
| KNO 3 | Нитрат калия | Калийная селитра |
| KClO 3 | Хлорат калия | Бертолетова соль |
| MgO | Оксид магния | Жженая магнезия |
Для некоторых наиболее известных или широко
распространенных веществ употребляются только
тривиальные названия, например: вода, аммиак,
метан, алмаз, графит и другие. В этом случае такие
тривиальные названия иногда называют специальными
.
Как составляются названия веществ, относящихся к
разным классам, вы узнаете из следующих
параграфов.
| Карбонат натрия Na 2 CO 3 .
Техническое (тривиальное) название –
кальцинированная (то есть прокаленная) сода, или
просто " сода" . Белое вещество, термически
очень устойчивое (плавится без разложения),
хорошо растворяется в воде, частично с ней
реагируя, при этом в растворе создается щелочная
среда. Карбонат натрия – ионное соединение со
сложным анионом, атомы которого связаны между
собой ковалентными связями. Сода ранее широко
применялась в быту для стирки белья, но сейчас
полностью вытеснена современными стиральными
порошками. Получают карбонат натрия по довольно
сложной технологии из хлорида натрия, а
используют, в основном, в производстве стекла. Карбонат
калия К 2 СО 3 .
Техническое
(тривиальное) название – поташ. По строению,
свойствам и применению карбонат калия очень
похож на карбонат натрия. Ранее его получали из
золы растений, да и сама зола использовалась при
стирке. Сейчас большая часть карбоната калия
получается в качестве побочного продукта при
производстве глинозема (Al 2 O 3),
используемого для производства алюминия. Из-за гигроскопичности поташ применяют в качестве осушающего средства. Используют его и в производстве стекла, пигментов, жидкого мыла. Кроме этого, карбонат калия – удобный реактив для получения других соединений калия. |
ХИМИЧЕСКАЯ
НОМЕНКЛАТУРА, СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ,
ТРИВИАЛЬНОЕ НАЗВАНИЕ, СПЕЦИАЛЬНОЕ НАЗВАНИЕ.
1.Выпишите
из предыдущих глав учебника десять тривиальных
названий любых соединений (отсутствующих в
таблице), запишите формулы этих веществ и дайте
их систематические названия.
2.О чем говорят тривиальные названия "
поваренная соль" , " кальцинированная
сода" , " угарный газ" , " жженая
магнезия" ?
8.2. Названия и формулы простых веществ
Названия большинства простых веществ
совпадают с названиями соответствующих
элементов. Только все аллотропные модификации
углерода имеют свои особые названия: алмаз,
графит, карбин и другие. Кроме этого имеет свое
особое название одна из аллотропных модификаций
кислорода – озон.
Простейшая формула простого немолекулярного
вещества состоит только из символа
соответствующего элемента, например: Na –
натрий, Fe – железо, Si – кремний.
Аллотропные модификации обозначают, используя
буквенные индексы или буквы греческого алфавита:
C (а) – алмаз; -
Sn –
серое олово;
С (гр) – графит; -
Sn –
белое олово.
В молекулярных формулах молекулярных простых
веществ индекс, как вы знаете, показывает число
атомов в молекуле вещества:
H 2 – водород; O 2 – кислород; Cl 2 –
хлор; O 3 – озон.
В соответствии с номенклатурными правилами
систематическое название такого вещества должно
содержать приставку, показывающую число атомов в
молекуле:
H 2 – диводород;
O 3 – трикислород;
P 4 – тетрафосфор;
S 8 – октасера и т. д., но в настоящее время
это правило еще не стало общеупотребительным.
Таблица 26.Числовые приставки
| Множитель | Приставка | Множитель | Приставка | Множитель | Приставка |
| моно | пента | нона | |||
| ди | гекса | дека | |||
| три | гепта | ундека | |||
| тетра | окта | додека |
| Озон O 3 – светло-синий газ с характерным запахом, в жидком состоянии – темно-голубой, в твердом – темно-фиолетовый. Это вторая аллотропная модификация кислорода. Озон значительно лучше растворим в воде, чем кислород. О 3 малоустойчив и даже при комнатной температуре медленно превращается в кислород. Очень реакционноспособен, разрушает органические вещества, реагирует со многими металлами, в том числе с золотом и платиной. Почувствовать запах озона можно во время грозы, так как в природе озон образуется в результате воздействия молний и ультрафиолетового излучения на атмосферный кислород.Над Землей существует озоновый слой, расположенный на высоте около 40 км, который задерживает основную часть губительного для всего живого ультрафиолетового излучения Солнца. Озон обладает отбеливающими и дезинфицирующими свойствами. В некоторых странах он используется для дезинфекции воды. В медицинских учреждениях для дезинфекции помещений используют озон, получаемый в специальных приборах – озонаторах. |
8.3. Формулы и названия бинарных веществ
В соответствии с общим правилом в формуле
бинарного вещества на первое место ставится
символ элемента с меньшей
электроотрицательностью атомов, а на второе – с
большей, например: NaF, BaCl 2 , CO 2 , OF 2
(а не FNa, Cl 2 Ba, O 2 C или F 2 O!).
Так как значения электроотрицательности для
атомов разных элементов постоянно уточняются,
обычно пользуются двумя практическими
правилами:
1. Если бинарное соединения представляет собой
соединение элемента, образующего металл, с
элементом,
образующим неметалл, то на первое место (слева)
всегда ставится символ элемента, образующего
металл.
2. Если оба элемента, входящие в состав соединения
– элементы, образующие неметаллы, то их символы
располагают в следующей последовательности:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Примечание: следует помнить, что место азота в этом практическом ряду не соответствует его электроотрицательности; в соответствии с общим правилом его следовало бы поместить между хлором и кислородом.
Примеры: Al 2 O 3 , FeO, Na 3 P, PbCl 2 , Cr 2 S 3 ,
UO 2 (по первому правилу);
BF 3 , CCl 4 , As 2 S 3 , NH 3 , SO 3 ,
I 2 O 5 , OF 2 (по второму правилу).
Систематическое название бинарного соединения
может быть дано двумя способами. Например, СО 2
можно назвать диоксидом углерода – это название
вам уже известно – и оксидом углерода(IV). Во
втором названии в скобках указывается число
Штока (степень окисления) углерода. Это делается
для того, чтобы отличить это соединение от СО –
оксида углерода(II).
Можно использовать и тот, и другой тип названия в
зависимости от того, какой в данном случае более
удобен.
Примеры (выделены более удобные названия):
| MnO | монооксид марганца | оксид марганца(II) |
| Mn 2 O 3 | триоксид димарганца | оксид марганца (III) |
| MnO 2 | диоксид марганца | оксид марганца(IV) |
| Mn 2 O 7 | гептаоксид димарганца | оксид марганца (VII) |
Другие примеры:
Если атомы элемента, стоящего в формуле
вещества на первом месте, проявляют только одну
положительную степень окисления, то ни числовые
приставки, ни обозначение этой степени окисления
в названии вещества обычно не используются,
например:
Na 2 O – оксид натрия; KCl – хлорид калия;
Cs 2 S – сульфид цезия; BaCl 2 – хлорид
бария;
BCl 3 – хлорид бора; HCl – хлорид водорода
(хлороводород);
Al 2 O 3 – оксид алюминия; H 2 S –
сульфид водорода (сероводород).
1.Составьте систематические названия веществ
(для бинарных веществ – двумя способами):
а) O 2 , FeBr 2 , BF 3 , CuO, HI;
б) N 2 , FeCl 2 , Al 2 S 3 , CuI, H 2 Te;
в) I 2 , PCl 5 , MnBr 2 , BeH 2 , Cu 2 O.
2.Назовите двумя способами каждый из оксидов
азота: N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 4 ,
N 2 O 5 . Подчеркните более удобные
названия.
3.Запишите формулы следующих веществ:
а) фторид натрия, сульфид бария, гидрид стронция,
оксид лития;
б) фторид углерода(IV), сульфид меди(II), оксид
фосфора(III), оксид фосфора(V);
в) диоксид кремния, пентаоксид дийода, триоксид
дифосфора, дисульфид углерода;
г) селеноводород, бромоводород, йодоводород,
теллуроводород;
д) метан, силан, аммиак, фосфин.
4.Сформулируйте правила составления формул
бинарных веществ по положению элементов,
входящих в состав этого вещества, в системе
элементов.
8.4. Формулы и названия более сложных веществ
Как вы уже заметили, в формуле бинарного
соединения на первом месте стоит символ катиона
или атома с частичным положительным зарядом, а на
втором – аниона или атома с частичным
отрицательным зарядом. Точно также составляются
формулы и более сложных веществ, но места атомов
или простых ионов в них занимают группы атомов
или сложные ионы.
В качестве примера рассмотрим соединение (NH 4) 2 CO 3 .
В нем на первом месте стоит формула сложного
катиона (NH 4 ), а
на втором – формула сложного аниона (CO 3 2).
В формуле самого сложного иона на первое место
ставится символ центрального атома, то есть
атома, с которым связаны остальные атомы (или
группы атомов) этого иона, а в названии
указывается степень окисления центрального
атома.
Примеры систематических названий:
Na 2 SO 4 тетраоксосульфат(VI) натрия(I),
K 2 SO 3 триоксосульфат(IV) калия(II),
CaCO 3 триоксокарбонат(IV) кальция(II),
(NH 4) 3 PO 4 тетраоксофосфат(V)
аммония,
PH 4 Cl хлорид фосфония,
Mg(OH) 2 гидроксид магния(II).
Такие названия точно отражают состав
соединения, но очень громоздки. Поэтому вместо
них обычно используют сокращенные (полусистематические
)
названия этих соединений:
Na 2 SO 4 сульфат натрия,
K 2 SO 3 сульфит калия,
CaCO 3 карбонат кальция,
(NH 4) 3 PO 4 фосфат аммония,
Mg(OH) 2 гидроксид магния.
Систематические названия кислот составляется
так, как будто кислота – соль водорода:
H 2 SO 4 тетраоксосульфат(VI) водорода,
H 2 CO 3 триоксокарбонат(IV) водорода,
H 2 гексафторосиликат(IV) водорода.(О
причинах применения квадратных скобок в формуле
этого соединения вы узнаете позже)
Но для наиболее известных кислот
номенклатурные правила допускают применение их
тривиальных названий, которые вместе с
названиями соответствующих анионов приведены в
таблице 27.
Таблица 27. Названия некоторых кислот и их анионов
Название |
Формула
ПОЛУСИСТЕМАТИЧЕСКИЕ
НАЗВАНИЯ КИСЛОТ И СОЛЕЙ.
| |||
Наиболее часто встречающиеся процессы образования этого соединения - гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
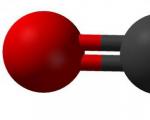
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:

Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO 2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде - в одном литре воды при 20 ⁰С растворяется около 0,88 л CO 2 . Небольшое понижение температуры кардинально меняет ситуацию - в том же литре воды при 17⁰С может раствориться 1,7 л CO 2 . При сильном охлаждении это вещество осаждается в виде снежных хлопьев - образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.

Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
С + СО 2 = 2СО.
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации - угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция - горение магния:
2Mg + CO 2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.

В химических соединениях СО 2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Na 2 O + CO 2 = Na 2 CO 3 ;
2NaOH + CO 2 = Na 2 CO 3 + H 2 O;
NaOH + CO 2 = NaHCO 3 .
Угольная кислота и раствор СО 2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
CO 2 + H 2 O ↔ H 2 CO 3.
Равновесие довольно сильно сдвинуто влево - лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура - тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.

Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н + и соединения НСО 3 - . В очень небольшом количестве образуются ионы СО 3 - .
Угольная кислота - двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные - гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение - карбонат кальция превращается в растворимое вещество - гидрокарбонат кальция. Реакция протекает по такому пути:
CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2 .
Получение диоксида углерода
Если требуется получить небольшое количество СО2, можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
CaCO 3 + HCl = CaCl 2 + H 2 O + CO 2 .
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН 4 + 2О 2 → 2H 2 O + CO 2 -.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
CaCO 3 = CaO + CO 2 .
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО 2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.

В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ - одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО 2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Энциклопедичный YouTube
-
1 / 5
Оксид углерода(IV) не поддерживает горения . В нём горят только некоторые активные металлы: :
2 M g + C O 2 → 2 M g O + C {\displaystyle {\mathsf {2Mg+CO_{2}\rightarrow 2MgO+C}}}Взаимодействие с оксидом активного металла:
C a O + C O 2 → C a C O 3 {\displaystyle {\mathsf {CaO+CO_{2}\rightarrow CaCO_{3}}}}При растворении в воде образует угольную кислоту :
C O 2 + H 2 O ⇄ H 2 C O 3 {\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows H_{2}CO_{3}}}}Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
C a (O H) 2 + C O 2 → C a C O 3 ↓ + H 2 O {\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ) K O H + C O 2 → K H C O 3 {\displaystyle {\mathsf {KOH+CO_{2}\rightarrow KHCO_{3}}}}Биологические
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки .
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он .
Углекислый газ (CO 2) транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ . Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина , а не с гемом . Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот - связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором . Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма - вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину , что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз , в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза .
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё - делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде .
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк , доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина , который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона .
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора , мела или соды с соляной кислотой , используя, например, аппарат Киппа . Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель , обозначается на упаковке кодом Е290 .
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги . При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений
Углекислый газ используется для газирования лимонада и газированной воды . Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл . В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний . Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,- таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота - «сухой лёд» - используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки .
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях - анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO 2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта . Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем . Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф . Для измерения низких концентраций CO 2 (а также ) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе .
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40-70°) широт Северного полушария.
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы : Венеры , Марса .
Токсичность
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.) русск. . Незначительные повышения концентрации до 2-4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7-10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья .
Хотя, фактически, даже концентрация 5-7 % CO 2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO 2 сильно влияет на самочувствие.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья .
В промышленности, основными способами производства двуокиси углерода CO2 являются ее получение как побочного продукта реакции конвертации метана CH4 в водород H2, реакций сжигания (окисления) углеводородов, реакции разложения известняка CaCO3 на известь CaO и воду H20.
CO2 как побочный продукт парового реформинга CH4 и других углеводородов в водород H2
Водород H2 требуется промышленности, прежде всего, для его использования в процессе производства аммиака NH3 (процесс Хабера, каталитическая реакция водорода и азота); аммиак же нужен для производства минеральных удобрений и азотной кислоты. Водород можно производить разными способами, в том числе и любимым экологами электролизом воды - однако, к сожалению, на данное время все способы производства водорода, кроме реформинга углеводородов, являются в масштабах крупных производств абсолютно экономически неоправданными - если только на производстве нет избытка «бесплатной» электроэнергии. Поэтому, основным способом производства водорода, в процессе которого выделяется и углекислый газ, является паровой реформинг метана: при температуре порядка 700...1100°C и давлении 3...25 бар, в присутствии катализатора, водяной пар H2O реагирует с метаном CH4 с выделением синтез-газа (процесс эндотермический, то есть идет с поглощением тепла):
CH4 + H2O (+ тепло) → CO + 3H2Аналогичным образом паровому реформингу можно подвергать пропан:
С3H8 + 3H2O (+ тепло) → 2CO + 7H2А также этанол (этиловый спирт):
C2H5OH + H2O (+ тепло) → 2CO + 4H2Паровому реформингу можно подвергать даже бензин. В бензине содержится более 100 разных химических соединений, ниже показаны реакции парового реформинга изооктана и толуола:
C8H18 + 8H2O (+ тепло) → 8CO + 17H2
C7H8 + 7H2O (+ тепло) → 7CO + 11H2Итак, в процессе парового реформинга того или иного углеводородного топлива получен водород и монооксид углерода CO (угарный газ). На следующем этапе процесса производства водорода, угарный газ в присутствии катализатора подвергается реакции перемещения атома кислорода O из воды в газ = CO окисляется в CO2, а водород H2 выделяется в свободной форме. Реакция экзотермическая, при ней выделяется порядка 40,4 кДж/моль тепла:
CO + H2O → CO2 + H2 (+ тепло)В условиях промышлененых предприятий, выделяющийся при паровом реформинге углеводородов диоксид углерода CO2 легко изолировать и собрать. Однако, CO2 в этом случае является нежелательным побочным продуктом, простой свободный выпуск его в атмосферу, хотя и является сейчас превалирующим путем избавления от CO2, нежелателен с экологической точки зрения, и некоторыми предприятиями практикуются более «продвинутые» методы, такие как, например, закачивание CO2 в нефтяные месторождения со снижающимся дебетом или закачивание его в океан.
Получение CO2 при полном сжигании углеводородного топлива
При сжигании, то есть окислении достаточным количеством кислорода углеводородов, таких как метан, пропан, бензин, керосин, дизельное топливо и др., образуются углекислый газ и, обычно, вода. Например, реакция сгорания метана CH4 выглядит так:
CH 4 + 2O 2 → CO 2 + 2H 2 OCO2 как побочный продукт получения H2 методом частичного окисления топлива
Порядка 95% промышленно производимого в мире водорода производится вышеописанным способом парового реформинга углеводородного топлива, прежде всего метана CH4, содержащегося в природном газе. Кроме парового реформинга, из углеводородного топлива с довольно высокой эффективностью можно получать водород и способом частичного окисления, когда метан и другие углеводороды реагируют с недостаточным для полного сжигания топлива количеством кислорода (напомним, что в процессе полного сжигания топлива, кратко описанным чуть выше, получается углекислый газ CO2 и вода H20). При подаче же меньшего, чем стехиометрическое, количества кислорода, продуктами реакции преимущественно являются водород H2 и монооксид углерода, он же угарный газ CO; в небольших количествах получаются и углексилый газ CO2, и некоторые другие вещества. Так как обычно, на практике, этот процесс проводят не с очищенным кислородом, а с воздухом, то как на входе, так и на выходе процесса имеется азот, который в реакции не участвует.
Частичное окисление является экзотермическим процессом, то есть в результате реакции выделяется тепло. Частичное окисление, как правило, протекает значительно быстрее, чем паровой реформинг, и требует меньшего по объему реактора. Как видно на примере приведенных ниже реакций, изначально частичное окисление производит меньше водорода на единицу топлива, чем получается в процессе парового реформинга.
Реакция частичного окисления метана CH4:
CH 4 + ½O 2 → CO + H 2 (+ тепло)Пропана C3H8:
C 3 H 8 + 1½O 2 → 3CO + 4H 2 (+ тепло)Этилового спирта C2H5OH:
C 2 H 5 OH + ½O 2 → 2CO + 3H 2 (+ тепло)Частичное окисление бензина на примере изооктана и толуола, из более чем ста химических соединений, присутствующих в бензине:
C 8 H 18 + 4O 2 → 8CO + 9H 2 (+ тепло)
C 7 H 18 + 3½O 2 → 7CO + 4H 2 (+ тепло)Для конвертации CO в углекислый газ и получения дополнительного водорода используется уже упомянутая в описании процесса парового реформинга реакция сдвига кислорода вода→газ:
CO + H 2 O → CO 2 + H 2 (+ небольшое количество тепла)CO2 при ферментации сахара
В производстве алкогольных напитков и хлебобулочных изделий из дрожжевого теста, используется процесс ферментации сахаров - глюкозы, фруктозы, сахарозы и др., с образованием этилового спирта C2H5OH и диоксида углерода CO2. Например, реакция ферментации глюкозы C6H12O6 такова:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2А ферментации фруктозы C12H22O11 - выглядит вот так:
C 12 H 22 O 11 + H 2 O → 4C 2 H 5 OH + 4CO 2Оборудование для производства CO2 пр-ва компании Wittemann
В производстве алкогольных напитков, получаемый алкоголь является желательным и даже, можно сказать, необходимым продуктом реакции брожения. Углекислый газ же иногда выпускается в атмосферу, а иногда оставляется в напитке для его газирования. В выпечке хлеба все происходит наоборот: CO2 нужен для образования пузырьков, вызывающих поднятие теста, а этиловый спирт почти полностью испаряется при выпечке.
Многие предприятия, прежде всего спиртозаводы, для которых CO 2 является совсем уж ненужным побочным продуктом, наладили его сбор и продажу. Газ из бродильных чанов через спиртовые ловушки подается в углекислотный цех, где CO2 очищают, сжижают и разливают в баллоны. Собственно, именно спиртовые заводы являются во многих регионах основными поставщиками углекислоты - и для многих из них, продажа углекислоты является отнюдь не последним источником доходов.
Существует целая отрасль производства оборудования для выделения чистого углекислого газа на пивоваренных и спиртовых заводах (Huppmann/GEA Brewery, Wittemann и др.), а также его прямого производства из углеводородного топлива. Поставщики газов, такие как Air Products и Air Liquide, также осуществляют установку станций по выделению CO 2 и его последующей очистке, сжижению у заправке в баллоны.
CO2 при производстве негашеной извести CaO из CaCO3
Процесс производства широко используемой негашеной извести CaO также имеет в качестве побочного продукта реакции двуокись углерода. Реакция разложения известняка CaCO3 эндотермическая, нуждается в температуре порядка +850°C и выглядит так:
CaCO3 → CaO + CO2Если же известняк (или другой карбонат металла) вступает в реакцию с кислотой, то в качестве одного из продуктов реакции выделяется углекисота H2CO3. Например, соляная кислота HCl реагирует с известняком (карбонатом кальция) CaCO3 следующим образом:
2HCl + CaCO 3 → CaCl 2 + H 2 CO 3Угольная кислота является очень нестойкой, и при атмосферных условиях быстро разлагается на CO2 и воду H2O.