Алхимики: Фенолы. Фенолы — номенклатура, получение, химические свойства
Это вещество было открыто в 1771 году. Сразу после открытия его стали использовать в качестве красителя. Текстильщики красили им свои ткани. В 1834 году немецкий химик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом, но ему не удалось определить его состав. И только в 1841 году Огюст Лоран установил его формулу.
- Определение фенолов.
- Классификация и изомерия фенолов.
Как видно из приведенных примеров, фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
- Физические свойства фенола.
Это объясняет, почему у фенола довольно высокие температуры плавления (+43 ) и кипения (+182 ). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Для более полного представления о физических свойствах посмотрите видеоролик:
- Строение молекулы фенола.
- неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О – Н еще сильнее поляризуется. Фенол- более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С - Н в положениях 2, 4, 6. и? – связи бензольного кольца.
- Химические свойства фенола.
а) кислотные свойства:
Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами,
так и с их гидроксидами (отсюда старинное название "карболовая кислота"):
Кислотные свойства у фенола выражены сильнее, чем у спирта С 2 Н 5 ОН. Фенол – слабая кислота (карболовая).
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
C 6 H 5 ONa + СО 2 + Н 2 О → С 6 Н 5 ОН + NaHCO 3 .
! Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.б) Образование сложных эфиров.
В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
С 6 Н 5 ОН + СН 3 ― CO ― Cl → С 6 Н 5 ― О― СО― СН 3 + HCl .
II. Реакции фенола по бензольному кольцу:
- взаимодействие с бромной водой:
- взаимодействие с азотной кислотой:
При нитровании фенола концентрированной азотной кислотой три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):
- реакция поликонденсации
- С 6 Н 5 ОН + FeCl 3 —> фиолетовое окрашивание
- С 6 Н 5 ОН + Br 2 —> белый осадок
- С 6 Н 4 (ОН) 2 + FeCl 3 —>зеленое окрашивание
- С 6 Н 3 (ОН) 3 + FeCl 3 —> красное окрашивание
IV. Окисление.
Фенолы легко окисляются
даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол
постепенно окрашивается в розовато-красный цвет. При энергичном
окислении фенола хромовой смесью основным продуктом окисления является
хинон. Двухатомные фенолы окисляются еще легче. При окислении
гидрохинона
также образуется хинон
:

- Получение фенола.
1 . Получение из галогенбензолов . При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С 6 Н 5 ― С l + 2 NaOH → C 6 H 5 ― ONa + NaCl + Н 2 О.
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон: (1)
(1)
3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
Фенол , химическое вещество органического происхождения, принадлежит к группе ароматических углеводородов.
В 1842 году французский органик Огюст Лоран сумел вывести формулу фенола (C6H5OH), состоящего из бензольного кольца и гидроксигруппы OH. Фенол имеет несколько названий, которые используются как в научной литературе, так и в разговорной речи, и возникли благодаря составу этого вещества. Так, фенол часто называют оксибензолом либо карболовой кислотой .
Фенол ядовит. Пыль и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Обладает слабокислотными свойствами, при действии щелочей образует соли - феноляты. При действии брома образуется трибромфенол, который используют для получения антисептика - ксероформа. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами в результате которых получаются полимерные продукты.
Физические свойства фенола
Химические свойства фенола
Фенол представляет собой кристаллическое вещество белого цвета, с характерным резким сладковато-приторным запахом, которое легко окисляется при взаимодействии с воздухом, приобретая сначала розоватый, а спустя некоторое время насыщенный бурый цвет. Особенностью фенола является прекрасная растворимость не только в воде, но и в спирте, щелочной среде, бензоле и ацетоне. Кроме этого, фенол обладает очень низкой температурой плавления и легко переходит в жидкое состояние при температуре +42°C, а также имеет слабые кислотные свойства. Поэтому при взаимодействии со щелочами фенол образует соли, именуемые фенолятами.
В зависимости от технологии производства и назначения фенол выпускают трех марок: А, Б и В по ГОСТ 23519-93. Ниже представлены его технические характеристики.
Технические характеристики фенола согласно ГОСТ 23519-93
|
Наименование показателя |
Значение | ||
| Марка А | Марка Б | Марка В | |
| Внешний вид | Белое
кристаллическое вещество |
Белое кристалли- ческое в-во. Допускается розоватый или желтоватый оттенок |
|
| Температура кристаллизации, °С, не ниже | 40,7 | 40,6 | 40,4 |
| Массовая доля нелетучего остатка, %, не более | 0,001 | 0,008 | 0,01 |
| Оптическая плотность водного раствора фенола (8,3 г марки А, 8,0 г марки Б, 5,0 г марки В в 100 см3воды) при 20 °С, не более |
0,03 | 0,03 | 0,03 |
| Оптическая плотность сульфированного фенола, не более | 0,05 | Не нормируют | |
| Цветность расплава фенола по платиново-кобальтовой шкале, единицы Хазена: |
|||
| у изготовителя, не более | 5 | Не нормируют | |
| у потребителя: | |||
| при
транспортировании по трубопроводу и в цистернах из нержавеющей стали, не более |
10 | То же | |
| при транспортировании в цистернах из
углеродистой стали и оцинкованных, не более |
20 | >> | |
| Массовая доля воды, %, не более | 0,03 | Не нормируют | |
| Массовая доля суммы органических примесей, %, не более | 0,01 | Не нормируют | |
| в том числе оксида мезитила, %, не более | 0,0015 | 0,004 | Не нормируют |
| суммы -метилстирола и изопропилбензола (кумола), %, не более | Не нормируют | 0,01 | То же |
Способы получения фенола
В чистом виде в природе фенол не встречается, он является искусственным продуктом органической химии. В настоящее время существует три основных способа получения фенола в промышленных объемах. Основная доля его производства приходится на так называемый кумпольный метод, который подразумевает окисление воздухом ароматического органического соединения изопропилбензола. В результате химической реакции получается гидропероксид кумпола, который при взаимодействии с серной кислотой разлагается на ацетон с последующим выпадением фенола в виде кристаллического осадка. Для производства также используется метилбензол (толуол), в результате окисления которого образуется данное химическое вещество и бензойная кислота. Кроме этого, в некоторых видах промышленности, таких, как производство металлургического кокса, фенол выделяется из каменноугольной смолы. Однако этот способ получения является нерентабельным из-за повышенной энергоемкости. Среди последних достижений химической промышленности – получение фенола путем взаимодействия бензола и уксусной кислоты, а также окислительное хлорирование бензола.
Впервые в промышленных объемах фенол был получен немецкой фирмой BASF в 1899 году, путем сульфирования бензола серной кислотой. Технология его производства заключалась в том, что впоследствии сульфокислота подвергалась щелочному плавлению, в результате чего образовывался фенол. Этот метод использовался более 100 лет, но во второй половине 20 века предприятия химической промышленности вынуждены были от него отказаться из-за огромного количества отходов сульфита натрия, который являлся побочным продуктом органического синтеза фенола.
В первой половине 20 века американская компания Dow Chemical внедрила еще один метод производства фенола, путем хлорирования бензола, который получил название «процесс Рашига». Метод оказался довольно эффективным, так как удельный вес получаемого вещества доходил до 85%. Впоследствии эта же фирма внедрила метод окисления метилбензлола с последующим разложением бензойной кислоты, однако из-за проблематичной деактивации катализатора сегодня он применяется примерно на 3-4% предприятий химической промышленности.
Наиболее эффективным является кумпольный метод получения фенола, который был разработан советским химиком Петром Сергеевым и внедрен в производство в 1942 году. Первый кумпольный завод, построенный в 1949 году в городе Дзержинске Горьковской области, смог обеспечить треть потребности СССР в феноле.
Область применения фенола
Первоначально фенол использовался для производства различного рода красителей, благодаря своему свойству изменять цвет в процессе окисления с бледно-розового до бурого оттенка. Это химическое вещество вошло в состав многих видов синтетических красок. Кроме этого, свойство фенола уничтожать бактерии и микроорганизмы, было взято на вооружение в кожевенном производстве при дублении шкур животных. Позже фенол успешно использовался в медицине как одно из средств обеззараживания и дезинфекции хирургических инструментов и помещений, а в качестве 1,4-процентного водного раствора - как болеутоляющее и антисептик для внутреннего и наружного применения. Кроме этого, фенол салициловой кислоты является основой аспирина, а ее производная – парааминосалициловая кислота – используется для лечения больных туберкулезом. Фенол также входит в состав сильнодействующего слабительного препарата – пургена.
В настоящее время основное предназначение фенола – химическая промышленность, где это вещество применяется для изготовления пластмассы, фенолформальдегидных смол, таких искусственных волокон, как капрон и нейлон, а также различных антиоксидантов. Кроме этого, фенол применяется для производства пластификаторов, присадок для масел, является одним из компонентов, входящих в состав препаратов по защите растений. Фенол также активно используется в генной инженерии и молекулярной биологии, в качестве средства для очистки и выделения молекул ДНК.
Вредные свойства фенола
Практически сразу после получения фенола ученые установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение непродолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом. При соприкосновении раствора фенола с кожей образуются химические ожоги, которые впоследствии трансформируются в язвы. Если обработать раствором более 25 процентов кожных покровов, то это может стать причиной смерти человека. Попадание фенола внутрь организма с питьевой водой, приводит к развитию язвенной болезни, атрофии мышц, нарушению координации движений, кровотечениям. Кроме этого, ученые установили, что именно фенол является причиной возникновения раковых заболеваний, способствует развитию сердечной недостаточности и бесплодия.
Благодаря свойству окисления, пары этого химического вещества полностью растворяются в воздухе примерно через 20-25 часов. При попадании в почву фенол сохраняет свои ядовитые свойства на протяжении суток. Однако в воде его жизнеспособность может достигать 7-12 дней. Поэтому наиболее вероятный путь попадания этого ядовитого вещества в человеческий организм и на кожные покровы – загрязненная вода.
В составе пластмасс фенол не теряет своих летучих свойств, поэтому использование фенопластов в пищевой промышленности, производстве предметов быта и детских игрушек на сегодняшний день категорически запрещено. Их применение также не рекомендовано для отделки жилых и служебных помещений, где человек проводит хотя бы несколько часов в сутки. Как правило, из организма фенол выводится с потом и мочой в течение 24 часов, однако за это время он успевает нанести здоровью человека непоправимый урон. Из-за вредных свойств во многих странах мира действует ограничение на использование данного вещества в медицинских целях.
Условия транспортировки и хранения
Существуют международные стандарты транспортировки фенола, разработанные для того, чтобы избежать выброса вещества в окружающую среду.
Фенол по железной дороге транспортируют в соответствии с правилами перевозок грузов в цистернах, снабженных устройством для обогрева. Цистерны должны быть изготовлены из нержавеющей хромоникелевой стали, углеродистой стали с цинковым покрытием или углеродистой стали. Фенол, предназначенный для производства медицинских препаратов, транспортируют в железнодорожных цистернах из нержавеющей хромоникелевой стали и углеродистой стали с цинковым покрытием. Фенол транспортируют также по обогреваемому трубопроводу, изготовленному из нержавеющей хромоникелевой стали.
Фенол в расплавленном и твердом состоянии хранят в герметичных резервуарах из нержавеющей хромоникелевой стали, углеродистой стали, покрытой цинком, или из углеродистой стали, а также в емкостях из монолитного алюминия. Допускается хранить фенол в расплавленном состоянии под азотом (объемная доля кислорода в азоте не должна превышать 2 %) при температуре (60 ± 10) °С в течение 2-3 сут. при хранении в емкостях из алюминия необходимо строго контролировать температуру во избежание растворения алюминия в продукте.
Фенолы – это производные аренов, у которых один или несколько атомов водорода ароматического кольца замещены на ОН-группу.
Классификация.
1. Одноатомные фенолы:
2. Многоатомные фенолы:

Физические свойства:
Фенол и его низшие гомологи – бесцветные низкоплавкие кристаллические вещества или жидкости с характерным запахом.
Фенол умеренно растворим в воде. Фенол способен образовывать водородные связи, что лежит в основе его антисептических свойств. Водные растворы фенола вызывают ожоги тканей. Разбавленный водный раствор фенола называется карболовой кислотой. Фенол – токсичен, токсичность гомологов фенола уменьшается, бактерицидная активность увеличивается по мере усложнения алкильного радикала.
Способы получения фенолов
1. Из каменноугольной смолы.
2. Кумольный метод

3. Сплавление солей ароматических сульфокислот с щелочью:
4. Разложение солей диазония:

5. Гидролиз галогенпроизводных

§11. Химические свойства фенолов .
1. Кислотные свойства: фенолы образуют соли:

Фенол – более слабая кислота, чем угольная Н 2 СО 3:

2. Реакции с участием ОН-группы.
а) алкилирование (образование простых эфиров)

б) ацилирование (образование сложных эфиров):

3. Реакции замещения ОН-группы:

Фенол с NH 3 и R – NH 2 не взаимодействует.
4. Реакции электрофильного замещения, характерные для аренов.
Замещение протекает быстрее, чем у бензола. ОН-группа направляет новый заместитель в орто- и пара-положения.
а) галогенирование (обесцвечивание бромной воды – качественная реакция на фенол):

б) нитрование

в) сульфирование:

5. Реакции конденсации
а) с формальдегидом

б) с фталевым ангидридом

6. Окисление
а) на воздухе белые кристаллы фенола розовеют;
б) фенол с раствором FeCl 3 дает красно-фиолетовое окрашивание;
крезол – голубое окрашивание;
в) окисление сильными окислителями

7. Восстановление

8. Карбоксилирование (реакция Кольбе – Шмитта):

Применение
1. Фенол применяется в производстве фенолформальдегидных смол, капролактама, пикриновой кислоты, красителей, инсектицидов, лекарственных средств.
2. Пирокатехин и его производные используются в производстве лекарственных средств (получен синтетический гормон – адреналин) и душистых веществ.
3. Резорцин применяют в синтезе красителей; в медицине в качестве дезинфицирующего средства.
Экспериментальная часть
Опыт 1 . Влияние радикала и количества гидроксильных групп на растворимость спиртов.
В три пробирки внесите 4-5 капель этилового, изоамилового спиртов и глицерина. В каждую пробирку добавьте по 5-6 капель воды, взболтайте. Что наблюдали?
Опыт 2. Обнаружение воды в этиловом спирте и его обезвоживание.
В сухую пробирку внесите 10 капель этилового спирта, добавьте немного обезвоженного сульфата меди, тщательно перемешайте, дайте отстояться. Если спирт содержит воду, осадок сульфата меди окрасится в голубой цвет вследствии образования медного купороса СuSO 4 · 5H 2 O. Сохраните обезвоженный спирт для дальнейшего опыта.
Опыт 3. Образование этилата натрия.
Поместите в сухую пробирку маленький кусочек натрия, добавьте 3 капли обезвоженного этилового спирта (из предыдущего опыта) и закройте отверстие пробирки пальцем. Тут же начинается выделение водорода.
По окончании реакции, не отрывая пальца от отверстия пробирки, поднесите ее к пламени горелки. При открытии пробирки водород воспламеняется с характерным звуком, образуя колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия или его раствор.
При добавлении в пробирку 1 капли спиртового раствора фенолфталеина появляется красное окрашивание.
Напишите уравнения протекающих реакций.
Опыт 4. Окисление этилового спирта хромовой смесью.
Введите в пробирку 3-4 капли этилового спирта. Добавьте 1 каплю 2н раствора серной кислоты и 2 капли 0,5н раствора бихромата калия. Полученный оранжевый раствор нагрейте над пламенем горелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок. Метод можно применять для распознавания первичных и вторичных спиртов.
Напишите уравнения реакций.
Опыт 5. Получение этилацетата.
В сухую пробирку поместите немного порошка обезвоженного ацетата натрия (высота слоя около 2мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно над пламенем горелки. Через несколько секунд появляется характерный приятный освежающий запах уксусноэтилового эфира.
Уравнения реакции:
СН 3 С(О)ОNа + НОSО 3 Н NаНSО 4 + СН 3 С(О)ОН
С 2 Н 5 ОН + НОSО 3 Н Н 2 О + С 2 Н 5 ОSО 3 Н
СН 3 С(О)ОН + НОSО 3 Н Н 2 SО 4 + СН 3 С(О)О С 2 Н 5
Опыт 6. Реакция глицерина с гидроксидом меди (II) в щелочной среде.
Поместите в пробирку 3 капли 0,2н раствора СuSO 4 , 2 капли 2н раствора NаОН и перемешайте. Появляется студенистый осадок гидроксида меди (II):
При нагревании в щелочной среде до кипения полученный гидроксид
меди (II) разлагается. Это обнаруживается по выделению черного осадка оксида меди (II):
Повторите опыт, но перед кипячением гидроксида меди (II) добавьте в пробирку 1 каплю глицерина. Взболтайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение

Опыт 7. Образовавние акролеина из глицерина.
Поместите в пробирку 3-4 кристалла бисульфата калия и 1 каплю глицерина. Нагрейте на пламени горелки. Признаком начавшегося разложения глицерина служит побурение жидкости в пробирке и появление тяжелых паров образующегося акролеина, обладающего очень резким запахом.
Опыт 8. Растворимость фенола в воде.
Поместите в пробирку 1 каплю жидкого фенола, добавьте 1 каплю воды и
взболтайте. Получится мутная жидкость – эмульсия фенола. При стоянии
такая эмульсия расслаивается, причем внизу будет раствор воды в феноле,
или жидкий фенол, а вверху – раствор фенола в воде, или карболовая вода.
Прибавляйте по каплям воду, каждый раз встряхивая пробирку, пока не
получится прозрачный раствор фенола в воде. Сохраните полученную
фенольную воду для последующих опытов.
Опыт 9 .Цветные реакции на фенольную воду.
Поместите в пробирку 3 капли прозрачной фенольной воды и добавьте 1 каплю 0,1н раствора FeCl 3 – появляется фиолетовое окрашивание.
Более чувствительной реакцией на фенол является цветная индофеноловая
Поместите в пробирку 1 каплю прозрачной карболовой воды. Добавьте к ней 3 капли 2н раствора NН 4 ОН и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно увеличивающееся за счет образования красящего вещества – индофенола.
Опыт 10. Образование трибромфенола.
Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды. Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок.

Опыт 11. Доказательство кислотного характера фенола.
К остатку фенольной воды добавьте еще 1 каплю фенола и встряхните. К вновь полученной эмульсии добавьте 1 каплю 2н раствора NаОН. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде.

§10. Задачи для самостоятельного решения .
1. Напишите структурные формулы следующих соединений:
3-метил-2-пентанол; 2-метил-3-бутин-2-ол; 1-фенилпропанол-1.
2. Реакцией Гриньяра получите следующие спирты:
1) 2-метил-3-пентанол;
2) 2,3-диметил-3-пентанол;
3) 2,2-диметил-1-пропанол.
3. Получите гидратацией соответствующих этиленовых углеводородов
следующие спирты:
а) 2-метилпентанол-2; б) 3,3-диметилбутанол-2.
4. Напишите реакции окисления вторичного бутилового спирта;
2-метилбутанола-1.
5. Подвергните 2-пентанол дегидратации, затем продукт реакции окислите водным раствором перманганата калия. Полученное соединение обработайте уксусной кислотой. Напишите уравнения реакций и назовите все продукты.
6. Получите фенол из бензола и 1-бутена через стадию образования гидроперекиси втор.бутила.
7. Опишите схему следующих превращений:
8. Расположите следующие соединения в порядке убывания кислотных свойств:

Гидроксибензол
Химические свойства
Что такое Фенол? Гидроксибензол, что это такое? Согласно Википедии – это один из простейших представителей своего класса ароматических соединений. Фенолы – это органические ароматические соединения, в молекулах которых к гидроксильной группе присоединены атомы углерода из ароматического кольца. Общая формула Фенолов: С6Н6n(ОН)n . Согласно стандартной номенклатуре, органические вещества этого ряда различают по числу ароматических ядер и ОН- групп. Различают одноатомные аренолы и гомологи, двухатомные арендиолы, терхатомные арентриолы и многоатомные формулы. Также Фенолам свойственно иметь ряд пространственных изомеров. Например, 1,2-дигидроксибензол (пирокатехин ), 1,4-дигидроксибензол (гидрохинон ) являются изомерами.
Спирты и Фенолы отличаются друг от друга наличием ароматического кольца. Этанол является гомологом метанола. В отличие от Фенола, метанол взаимодействует с альдегидами и вступает в реакции этерификации. Утверждение, что гомологами являются метанол и Фенол неверно.
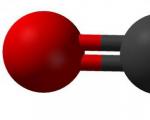
Его подробно рассмотреть структурную формулу Фенола, то можно отметить, что молекула представляет собой диполь. При этом бензольное кольцо – отрицательный конец, а группа ОН – положительный. Наличие гидроксильной группы обуславливает повышение электронной плотности в кольце. Неподеленная пара электронов кислорода вступает в сопряжение с пи-системой кольца, а для атома кислорода характерна sp2 гибридизация. Атомы и атомные группы в молекуле обладают сильным взаимным влиянием друг на друга, и это отражается на физических и химических свойствах веществ.
Физические свойства. Химическое соединение имеет вид бесцветных игольчатых кристаллов, которые розовеют на воздухе, так как подвержены окислению. У вещества специфический химический запах, оно умеренно растворимо в воде, спиртах, щелочи, ацетоне и бензоле. Молярная масса = 94,1 грамм на моль. Плотность = 1,07 г на литр. Кристаллы плавятся при 40-41 градусах Цельсия.
С чем взаимодействует Фенол? Химические свойства Фенола. В связи с тем, что молекула соединения содержится, как ароматическое кольцо, так и гидроксильную группу, то оно проявляет некоторые свойства спиртов и ароматических углеводородов.
С чем реагирует группа ОН ? Вещество не проявляет сильных кислотных свойств. Но является более активным окислителем, чем спирты, в отличие от этанола взаимодействует с щелочами образуя соли-феноляты. Реакция с гидроксидом натрия : С6Н5ОН + NaOH → C6H5ONa + H2O . Вещество вступает в реакцию с натрием (металлическим): 2C6H5OH + 2Na → 2C6H5ONa + H2 .
Фенол не реагирует с карбоновыми кислотами. Эфиры получают при взаимодействии солей фенолятов с галогенангидридами или ангидридами кислот. Для химического соединения не характерны реакции образования простых эфиров. Эфиры образуют феноляты при действии на них галогеналканов или галогенпроизводных аренов. Гидроксибензол реагирует с цинковой пылью, при этом происходит замещение гидроксильной группы на Н , уравнение реакции выглядит следующим образом: C6H5OH + Zn → C6H6 + ZnO .
Химическое взаимодействие по ароматическому кольцу. Для вещества характерны реакции электрофильного замещения, алкилирования, галогенирования, ацилирования, нитрования и сульфирования. Особое значение имеет реакций синтеза салициловой кислоты: C6H5OH + CO2 → C6H4OH(COONa) , протекает в присутствии катализатора гидроксида натрия . Затем при воздействии образуется .
Реакция взаимодействия с бромной водой является качественной реакцией на Фенол. C6H5OH + 3Br2 → C6H2Br2OH + 3HBr . При бромировании образуется твердое белое вещество — 2,4,6-трибромфенол . Еще одна качественная реакция – с хлоридом железа 3 . Уравнение реакции выглядит следующим образом: 6C6H5OH + FeCl3 → (Fe(C6H5OH)6)Cl3 .
Реакция нитрования Фенола: C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3 H2O . Для вещества также характерна реакция присоединения (гидрирования) в присутствии металлических катализаторов, платины, оксида алюминия, хрома и так далее. В результате образуются циклогексанол и циклогексанон .
Химическое соединение подвергается окислению. Устойчивость вещества значительно ниже, чем у бензола. В зависимости от условий реакции и природы окислителя образуются разные продукты реакции. Под действием перекиси водорода в присутствии железа образуется двухатомный Фенол; при действии диоксида марганца , хромовой смеси в подкисленной среде – пара-хинон.
Фенол реагирует с кислородом, реакция горения: С6Н5ОН +7О2 → 6СО2 + 3Н2О . Также особое значение для промышленности имеет реакция поликонденсации с формальдегидом (например, метаналем ). Вещество вступает в реакцию поликонденсации до тех пор, пока не израсходуется полностью один из реагентов и не образуются огромные макромолекулы. В результате образуются твердые полимеры, фенолформальдегидные или формальдегидные смолы . Фенол не взаимодействует с метаном.
Получение. На данный момент существуют и активно применяются несколько методов синтеза гидроксибензола. Кумольный способ получения Фенола является наиболее распространенным из них. Таким способом синтезируют порядка 95% всего объема производства вещества. При этом некаталитическому окислению воздухом подвергается кумол и образуется гидропероксид кумола . Полученное соединение разлагается под действием серной кислоты на ацетон и Фенол. Дополнительным побочным продуктом реакции является альфа-метилстирол .
Также соединение можно получить при окислении толуола , промежуточным продуктом реакции будет являться бензойная кислота . Таким образом, синтезируют около 5% вещества. Все остальное сырье для различных нужд выделяют из каменноугольной смолы.
Как получить из бензола? Фенол можно получить с помощью реакции прямого окисления бензола NO2 () с дальнейшим кислотным разложением гидропероксида втор-бутилбензола . Как из хлорбензола получить Фенол? Существует два варианта получения из хлорбензола данного химического соединения. Первый – реакция взаимодействия со щелочью, например, с гидроксидом натрия . В результате образуется Фенол и поваренная соль. Второй – реакция с водяным паром. Уравнение реакции выглядит следующим образом: C6H5-Cl + H2O → C6H5-OH + HCl .
Получение бензола из Фенола. Для этого сначала требуется обработать бензол хлором (в присутствии катализатора), а затем прибавить к полученному соединению щелочь (например, NaOH ). В итоге образуется Фенол и .
Превращение метан — ацетилен — бензол — хлорбензол можно осуществить следующим образом. Сначала проводится реакция разложения метана при высокой температуре 1500 градусов Цельсия до ацетилена (С2Н2 ) и водорода. Затем ацетилен при особых условиях и высокой температуре переводят в бензол . К бензолу прибавляют хлор в присутствии катализатора FeCl3 , получают хлорбензол и соляную кислоту: C6H6 + Cl2 → C6H5Cl + HCl .
Одним из структурных производных Фенола является аминокислота , которая имеет важное биологическое значение. Данную аминокислоту можно рассмотреть в виде пара-замещенного Фенола или альфа-замещенного пара-крезола . Крезолы – достаточно распространены в природе на ряду с полифенолами. Также свободную форму вещества можно обнаружить в некоторых микроорганизмах в равновесном состоянии с тирозином .
Гидроксибензол применяется:
- при производстве бисфенола А , эпоксидной смолы и поликарбоната ;
- для синтеза фенолформальдегидных смол, капрона, нейлона;
- в нефтеперерабатывающей промышленности, при селективной очистке масел от ароматических соединений серы и смол;
- при производстве антиоксидантов, поверхностно-активных веществ, крезолов , лек. препаратов, пестицидов и антисептических препаратов;
- в медицине в качестве антисептического и обезболивающего средства для местного использования;
- в качестве консерванта при изготовлении вакцин и копченых продуктов питания, в косметологии при проведении глубокого пилинга;
- для дезинфекции животных в скотоводстве.
Класс опасности. Фенол – крайне токсичное, ядовитое, едкое вещество. При вдыхании летучего соединения нарушается работа центральной нервной системы, пары раздражают слизистую глаз, кожу, дыхательные пути и вызывают сильные химические ожоги. При попадании на кожу вещество быстро всасывается в кровоток и достигает тканей мозга, вызывая паралич дыхательного центра. Смертельная доза при приеме внутрь для взрослого составляет от 1 до 10 грамм.
Фармакологическое действие
Антисептическое, прижигающее.
Фармакодинамика и фармакокинетика
Средство проявляет бактерицидную активность по отношению в аэробным бактериям, их вегетативным формам и грибам. Практически не оказывает влияния на споры грибов. Вещество вступает во взаимодействие с белковыми молекулами микробов и приводит к их денатурации. Таким образом, нарушается коллоидное состояние клетки, значительно повышается ее проницаемость, нарушаются окислительно-восстановительные реакции.
В водном растворе является отличным дезинфицирующим средством. При использовании 1,25% раствора практически микроорганизмы погибают в течение 5-10 минут. Фенол, в определенной концентрации оказывает прижигающее и раздражающее действие на слизистую оболочку. Бактерицидный эффект от применения средства усиливается с ростом температуры и кислотности.
При попадании на поверхность кожи, даже если она не повреждена, лекарство быстро всасывается, проникает в системный кровоток. При системной абсорбции вещества наблюдается его токсическое действие, преимущественно на центральную нервную систему и дыхательный центр в головном мозге. Порядка 20% от принятой дозы подвергается окислению, вещество и продукты его метаболизма выводятся с помощью почек.
Показания к применению
Применение Фенола:
- для дезинфекции инструментов и белья и дезинсекции;
- в качестве консерванта в некоторых лек. средствах, вакцинах, свечах и сыворотках;
- при поверхностных пиодермиях , фолликулите , фликтене , остиофолликулите , сикозе , стрептококковом импетиго ;
- для лечения воспалительных заболеваний среднего уха, ротовой полости и глотки, пародонтита , генитальных остроконечных кондилом .
Противопоказания
Вещество не используют:
- при распространенных поражениях слизистой оболочки или кожи;
- для лечения детей;
- во время кормления грудью и ;
- при на Фенол.
Побочные действия
Иногда лекарственное средство может спровоцировать развитие аллергических реакций, зуд, раздражение в месте нанесения и чувство жжения.
Инструкция по применению (Способ и дозировка)
Консервацию лекарственных препаратов, сывороток и вакцин проводят с помощью 0,5% растворов Фенола.
Для наружного применения лекарство используют в виде мази. Препарат наносят тонким слоем на пораженные участки кожи несколько раз в сутки.
При лечении вещество используют в форме 5% раствора в . Препарат подогревают и закапывают по 10 капель в пораженное ухо на 10 минут. Затем необходимо удалить остатки лекарства с помощью ваты. Процедуру повторяют 2 раза в день в течение 4 суток.
Препараты Фенола для лечения ЛОР-заболеваний используют в соответствии с рекомендациями в инструкции. Продолжительность терапии – не более 5 дней.
Для ликвидации остроконечных кондилом их обрабатывают 60% раствором Фенола или 40% раствором трикрезола . Процедуру проводят один раз в 7 дней.
При дезинфекции белья применяют 1-2% растворы на основе мыла. С помощью мыльно-фенольного раствора обрабатывают помещение. При дезинсекции используются фенольно-скипидарные и керосиновые смеси.
Передозировка
При попадании вещества на кожу возникают жжение, покраснение кожи, анестезия пораженного участка. Поверхность обрабатывают растительным маслом или полиэтиленгликолем . Проводят симптоматическую терапию.
Симптомы отравления Фенолом при попадании внутрь. Наблюдаются сильные боли в животе, глотке, в ротовой полости, пострадавшего рвет бурой массой, бледность кожи, общая слабость и головокружение
Средством нельзя обрабатывать обширные участки кожи.
Перед использованием вещества для дезинфекции предметов быта, их необходимо механически очистить, так как средство абсорбируется органическими соединениями. После обработки вещи могут еще длительное время сохранять специфический запах.
Химическое соединение нельзя использовать для обработки помещений для хранения и готовки пищевой продукции. Оно не влияет на окраску и структуру ткани. Повреждает поверхности, покрытые лаком.
Детям
Средство нельзя использовать в педиатрической практике.
При беременности и лактации
Фенол не назначают во время кормления грудью и при беременности .
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Фенол входит в состав следующих препаратов: Ферезол , Фенола раствор в глицерине , Фармасептик . В качестве консерванта содержится в препаратах: Экстракт Белладонны , Набор для кожной диагностики медикаментозной аллергии , и так далее.
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле (рис.1)
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
В соответствии с количеством конденсированных ароматических циклов в молекуле различают (рис. 2) сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы (рис. 2).
Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ
Номенклатура спиртов.
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы , входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей (рис. 3).
Рис. 3. НОМЕНКЛАТУРА ФЕНОЛОВ . Замещающие группы и соответствующие цифровые индексы для наглядности выделены различными цветами.
Химические свойства фенолов.
Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе (рис. 4). В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком d+), полярность связи О–Н возрастает, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через d–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Рис. 4. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В ФЕНОЛЕ
В итоге для фенолов возможны два типа превращений: замещение атома водорода в ОН-группе и замещение Н-атомобензольном ядре. Пара электронов атома О, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи, характерные для спиртов, для фенолов не типичны.
1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочей образуются феноляты (рис. 5А), каталитическое взаимодействие со спиртами приводит к простым эфирам (рис. 5Б), а в результате реакции с ангидридами или хлорангидридами карбоновых кислот образуются сложные эфиры (рис. 5В). При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH 2 , образуется анилин, (рис. 5Г), восстанавливающие реагенты превращают фенол в бензол (рис. 5Д)
2. Реакции замещения атомов водорода в бензольном кольце.
При галогенировании, нитровании, сульфировании и алкилировании фенола атакуются центры с повышенной электронной плотностью (рис.4), т.е. замещение проходят преимущественно в орто- и пара- положениях (рис.6).
При более глубоком протекании реакции происходит замещение двух и трех атомов водорода в бензольном кольце.
Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами, по существу, это алкилирование, проходящее легко и в мягких условиях (при 40–50° С, водная среда в присутствии катализаторов), при этом атом углерода в виде метиленовой группы СН 2 или замещенной метиленовой группы (CНR либо CR 2) встраивается между двумя молекулами фенола. Часто такая конденсация приводит к образованию полимерных продуктов (рис. 7).
Двухатомный фенол (торговое название бисфенол А, рис.7), используют в качестве компонента при получении эпоксидных смол. Конденсация фенола с формальдегидом лежит в основе производства широко применяемых феноло-формальдегидных смол (фенопласты).
Способы получения фенолов.
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С 6 Н 5 ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H 2 SO 4 (рис. 8А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ – каталитический гидролиз галогензамещенных бензолов (рис. 8Б).
Рис. 8. СПОСОБЫ ПОЛУЧЕНИЯ ФЕНОЛА
Применение фенолов.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара- дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Михаил Левицкий