ДНК человека может меняться в течение жизни? Генетика. Можно ли изменить генетический код человека
Изменение ДНК человека которое передается будущим поколениям уже давно считается этически закрытым и запрещенным во многих странах. Ученые сообщают, что они используют новые инструменты для ремонта болезнетворных генов в эмбрионах человека. Хотя исследователи используют дефектные эмбрионы и не собираются имплантировать их в матку женщины, работа вызывает опасение.
Изменение ДНК человеческих яйцеклеток, спермы или эмбрионов известно как герминативное изменение. Многие ученые призывают к мораторию на пересмотр клинических эмбрионов, редактирование зародышевой линии человека и многие считают, что этот вид научной деятельности должен быть запрещен.
Однако, редактирование ДНК человеческого эмбриона может быть этически допустимо, чтобы предотвратить болезнь у ребенка, но только в редких случаях и с гарантиями. Эти ситуации могут быть ограниченно введены для пар, когда они оба имеют серьезные генетические заболевания и для кого редактирование эмбриона действительно последний разумный вариант, если они хотят иметь здорового ребенка.
Опасность преднамеренного изменения генов
Ученые считают, что редактирование эмбриона человека может быть приемлемым, чтобы предотвратить ребенка от наследования серьезных генетических заболеваний, но только при соблюдении определенной техники безопасности и этических критериев. Например, пара не может иметь “разумные альтернативы”, такие как возможность выбора здоровых эмбрионов для экстракорпорального оплодотворения (ЭКО) или с помощью пренатальных тестов и аборта плода с болезнью. Другая ситуация, которая может удовлетворить критериям, если оба родителя имеют одинаковые заболевания, такие как, например, кистозный фиброз.
Ученые предупреждают о необходимости строгого государственного надзора, чтобы предотвратить использование редактирования зародышевой линии для других целей, например, чтобы дать ребенку желаемые, отличительные от остальных черты.
Редактирование генов в клетках пациентов, которые не наследуются, клинические испытания уже ведутся для борьбы с ВИЧ, гемофилией и лейкозом. Считается, что существующие регуляторные системы для генной терапии которые являются достаточными для проведения таких работ.
Редактирование генома не должно быть для повышения потенции, повышения у здорового человека мышечной силы или снижения уровня холестерина.
Редактирование генов человеческой зародышевой линии или модификация зародышевой линии человека означает преднамеренное изменение генов передающееся детям и будущим поколениям.
Другими словами, создание генно-модифицированных людей . Модификация зародышевой линии человека на протяжении многих лет считается запретной темой в связи с безопасностью и социальными причинами. Это формально запрещено в более чем 40 странах.
Опыты по созданию генно-модифицированных людей и наука евгеника
Однако, в последние годы, по новым методам генной инженерии, проводились опыты с человеческими эмбрионами. Для исследований использовались гены и человеческие эмбрионы связанные с бета-заболеванием крови — талассемией. Эксперименты были в основном безуспешными. Но инструменты редактирования генов совершенствуются в лабораториях по всему миру и ожидается, что они позволят легче, дешевле и более точнее редактировать или удалять гены, чем когда-либо прежде. Современные пока теоретические способы редактирования генома позволят ученым вставлять, удалять и подправлять ДНК с получением положительных результатов. Это открывает перспективу лечения некоторых заболеваний, таких как серповидно-клеточные заболевания, муковисцидоз и определенные виды рака.
Селекция применительно к человеку — евгеника
Редактирование генов человеческих эмбрионов или направление евгеника приводит к созданию генетически модифицированных очень разных людей. Это вызывает серьезную безопасность в связи с социальными и этическими проблемами. Они варьируются от перспективы необратимого вреда для здоровья будущих детей и поколений до открывания дверей к новым формам социального неравенства, дискриминации и конфликтов и новой эре евгеники.
Наука евгеника по селекции человека попала в середине прошлого века как наука нацистского направления.
Ученым не разрешено вносить изменения в ДНК человека, который передается последующим поколениям. Такой новаторский шаг науки евгеники следует рассматривать лишь после дополнительных исследований, после чего изменения могут быть проведены в условиях жестких ограничений. Такие работы должны быть запрещены, чтобы предотвратить серьезные заболевания и инвалидности.
Изменчивость вызванную изменением генов называют ещё мутациями.
Это давнее табу на внесение изменений в гены человеческой спермы, яйцеклеток или эмбрионов, потому что такие изменения будут унаследованы будущими поколениями. Это табу отчасти из-за опасений, что ошибки могут непреднамеренно создать новые искусственные болезни, которые потом могут стать постоянной частью человеческого генофонда.
Другая проблема заключается в том, что этот вид может быть использован для генетической модификации для немедицинских причин. Например, ученые теоретически могут попытаться создать конструктор детей, в которых родители пытаются выбрать черты характера своих детей, чтобы сделать их умнее, выше, лучшими спортсменами или с другими якобы необходимыми атрибутами.
Ничего подобного в настоящее время не возможно. Но даже перспектива вызывает опасения ученых существенно изменить ход эволюции и создания людей, которые считаются генетически улучшенными, придумывать какие антиутопии будущего, описанные в фильмах и книгах.
Любая попытка создания младенцев от спермы, яйцеклеток или эмбрионов, которые имеют свои ДНК и пытаться редактировать можно только при очень тщательно контролируемых условиях и только для предотвращения разрушительного заболевания.
Это может быть сложно в дальнейшем провести грань между использованием генного редактирования, чтобы предотвратить или обработать заболевание и использовать его для повышения возможностей человека.
Например, если ученым удается выяснить, что изменения генов повышают мыслительные способности, чтобы отбиваться от деменции при болезни Альцгеймера, то это можно считать профилактической медициной. Если просто кардинально улучшить память здорового человека, то это уже не медицинское направление.
Когда разрешено изменять ДНК
Возможность редактирования генов и может быть использована для лечения многих заболеваний и, возможно, даже предотвратить многие разрушительные расстройства от происходящих в первую очередь путем редактирования из генетических мутаций в сперме, яйцеклетке и эмбрионе. Некоторые потенциальные изменения могли бы предотвратить широкий спектр заболеваний, включая рак молочной железы, болезнь Тея-Сакса, серповидноклеточную анемию, кистозный фиброз и болезнь Хантингтона.
Клинические испытания редактирования генов должны быть разрешены, если:
- нет «разумной альтернативы», чтобы не допустить «серьезного заболевания»
- убедительно доказано, что гены, будучи отредактированы устраняют причину заболевания
- изменения направлены лишь на преобразование таких генов которые связаны с обычным состоянием здоровья
- проведена достаточная предварительная исследовательская работа на тему рисков и потенциальных выгод для здоровья
- постоянный, строгий надзор для изучения влияния процедуры на здоровье и безопасность участников, а также долгосрочные комплексные планы
- есть максимальная прозрачность в соответствии с конфиденциальностью пациента и ведется переоценка, здоровья, социальные выгоды и риски
- есть надежные надзорные механизмы, чтобы предотвратить расширение серьезной болезни или состояния.
Сторонники редактирования зародышевой линии человека, утверждают, что это могло бы потенциально уменьшить или даже устранить, возникновение многих серьезных генетических заболеваний уменьшили бы человеческие страдания во всем мире. Оппоненты говорят, что изменения человеческих эмбрионов опасно и противоестественно, и не учитывает согласие будущих поколений.
Дискуссия по изменению зародыша человека
 Начнем с возражением о том, что изменение зародыша — это противоестественно или играть против Бога.
Начнем с возражением о том, что изменение зародыша — это противоестественно или играть против Бога.
Этот аргумент основывается на предпосылке, что естественное по своей сути хорошее.
Но болезни являются естественными и люди миллионами заболевают и умирают преждевременно-все совершенно естественно. Если бы мы только охраняли природные существа и природные явления, мы бы не смогли использовать антибиотики, чтобы убить бактерии или иначе занимались бы медициной или боролись с засухой, голодом, мором. Система здравоохранения ведется в каждой развитой стране и может быть справедливо охарактеризована как часть всеобъемлющей попытки сорвать ход природы. Что естественно не является ни хорошим, ни плохим. Природные вещества или естественные методы лечения лучше, если они, конечно, возможны.
Приводит к важному моменту в истории медицины и редактирование генома и представляет перспективные начинания науки на благо всего человечества.
Вмешательство в геном человека допущено только в профилактических, диагностических или терапевтических целях и без внесения модификаций для потомков.
Стремительный прогресс в области генетики так называемый “дизайнер младенцев” увеличивает необходимость биоэтики для широкой общественной и ведении дискуссии о силе науки. Наука способна генетически модифицировать человеческие эмбрионы в лаборатории, чтобы контролировать унаследованные черты, такие как внешний вид и интеллект.
По состоянию на сейчас многие страны подписали международную Конвенцию, запрещающую этот вид редактирования генов и изменение ДНК.
ДНК - это химическое вещество, которое подвержено внешнему влиянию. Эти влияния могут быть физическими (температура, ультрафиолетовое и радиационное излучение) или химическими (свободные радикалы, канцерогены и т. п.).
Температура
При повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 раза. Конечно, в клеточном ядре (там, где хранится ДНК) нет таких перепадов температуры. Но есть небольшие изменения, которые могут привести к тому, что ДНК прореагирует с каким-нибудь веществом, растворенным неподалеку.
УЛЬТРАФИОЛЕТ
Ультрафиолет действует на нас почти всегда. Зимой это ничтожные дозы. Летом - значительные. Если ультрафиолетовый фотон попадает в молекулу ДНК, его энергии хватает для образования новой химической связи. Соседние звенья ДНК (нуклеотиды) могут образовать дополнительную связь друг с другом, что приведет к нарушению считывания и репликации ДНК. Или же УФ фотон может привести в разрыву нити ДНК из-за своей высокой энергии.
РАДИАЦИЯ
Радиационное излучение. Вы думаете, оно только на реакторе? Есть так называемый нормальный радиационный фон, то есть вокруг и через нас каждую секунду пролетает несколько частиц, и не всегда это происходит бесследно для нашей ДНК. Чтобы понять масштабность радиационного фона, посмотрите .
Но не стоит бояться. Фон не зря назван нормальным. Далеко не все частицы проходят через кожу, из проникнувших не все проникают глубоко, а те, что проникли, часто врезаются в другие молекулы и атомы в клетке, которых очень много. Лишь единицы добираются до ДНК, и то могут не оказать никакого эффекта на нее.
Кстати, чем выше над землей, тем радиационный фон ярче. Связано это с космической радиацией, от которой нас в большей степени защищает магнитное поле земли и атмосфера. Чем дальше от земли, тем магнитное поле слабее и слой атмосферы тоньше, и большее число высокоэнергетических частиц бомбардируют наше тело.
СВОБОДНЫЕ РАДИКАЛЫ
Среди химических бОльшая роль отводится именно свободным радикалам, которые постоянно образуются в клетке. Это побочный продукт окислительно-восстановительных процессов, без которых невозможна жизнь. Конечно, за миллионы лет эволюции выжили только те организмы, у которых возникла система нейтрализации свободных радикалов. У нас она тоже есть. Но ничто не работает со 100% эффективность, и нет-нет, да несколько радикалов умудряются повредить ДНК.
Кстати о радиации. Она также ответственна за образование свободных радикалов. Те высокоэнергетические частицы, которые прореагировали с веществами, окружающими ДНК, часто приводят в образованию радикалов.
КАНЦЕРОГЕНЫ
Что касается канцерогенов, то хорошим примером является бензпирен - вещество, образующееся при горении угля и углеводородов, например бензина. Он содержится в выхлопных газах и дыме от костра. Безпирен имеет высокое сродство к ДНК и встраивается в структуру ДНК, нарушая тем самым последовательность нуклеотидов. Есть и другие механизмы повреждения ДНК.
Внешними воздействиями причины не ограничены. Внутренняя кухня тоже не без изъяна. ДНК - динамичная молекула, которая часто удваивается, постоянно распутывается и спутывается, меняет свое положение в пространстве. Не все из этих процессов проходят гладко, и могут возникать разрывы нити ДНК, перестановка и даже потеря участков цепи, слияние нескольких молекул в одну. При делении клетки не все хромосомы могут поспеть за вновь образующимися клетками, и у одной из дочерних клеток может оказаться меньше хромосом, а у другой больше. Это тоже мутация.
Удвоение ДНК тоже происходит не точь-в-точь, а с ошибками. Более того, каждая копия немного короче оригинала, потому что края (теломеры) сложно скопировать. Рано или поздно (когда мы уже старые) теломеры укорачиваются настолько, что в "под нож" попадают кодирующие участки ДНК.
Все это звучит страшно, но во-первых, часто мутации являются безразличными и редко имеют негативные последствия, во-вторых в ходе эволюции возник механизм починки повреждений ДНК, который неплохо справляется со своими обязанностями, а в-третьих, мутационный процесс необходимый компонент для эволюции и позволяет появиться на свет тому, чего в природе еще не было.
Дженнифер Дудна — известная ученая из США, труды которой в основном посвящены структурной биологии и биохимии. Дженнифер лауреатка многих престижных премий, в 1985 году получила степень бакалавра, а уже в 89 году стала доктором философии в Гарвардском университете. С 2002 года работает в Калифорнийском университете в Беркли. Широкую известность получила как исследователь РНК-интерференции и CRISPR. Исследования по Cas9 проводила вместе с Эммануэль Шарпантье.
00:12
Несколько лет назад мы с моей коллегой Эммануэль Шарпентье изобрели новую технологию редактирования геномов. Она называется CRISPR-Cas9. Технология CRISPR позволяет учёным вносить изменения в ДНК внутри клеток, что может дать нам возможность вылечивать генетические заболевания.
00:31
Возможно, вам будет интересно узнать, что технология CRISPR возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями. Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы её обезвредить до того как бактерия будет разрушена. В клетках многих бактерий существует адаптивная иммунная система - CRISPR, позволяющая им выявлять и разрушать вирусную ДНК.
01:04
В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом. И именно в ходе нашего исследования по изучению активности этого белка, Cas9, мы поняли, что можем использовать его активность в генно-инженерной технологии, которая позволит учёным удалять и вставлять фрагменты ДНК внутрь клеток с невероятной точностью, что позволило бы делать то, что ранее было просто невозможно.
01:42
Технология CRISPR уже используется для изменения ДНК в клетках мышей и обезьян, а также других организмов. Недавно китайские учёные показали, что им удалось использовать технологию CRISPR даже для изменения генов эмбрионов человека. Учёные из Филадельфии показали возможность применения CRISPR для удаления ДНК интегрировавшегося вируса ВИЧ из инфицированных клеток человека.
02:09
Возможность осуществлять редактирование генома таким образом также вызывает различные этические вопросы, которые следует иметь в виду, потому что технологию можно применять не только к клеткам взрослых, но также и к эмбрионам разных организмов, в том числе и нашего вида. Таким образом, вместе с коллегами мы начали международное обсуждение изобретённой нами технологии, чтобы иметь возможность учесть все этические и общественные проблемы, связанные с подобными технологиями.
02:39
А сейчас я хочу рассказать вам, что такое технология CRISPR, что она позволяет делать, на каком мы сейчас этапе и почему я считаю, что нам нужно с осторожностью продвигаться вперёд по пути применения этой технологии.
02:54
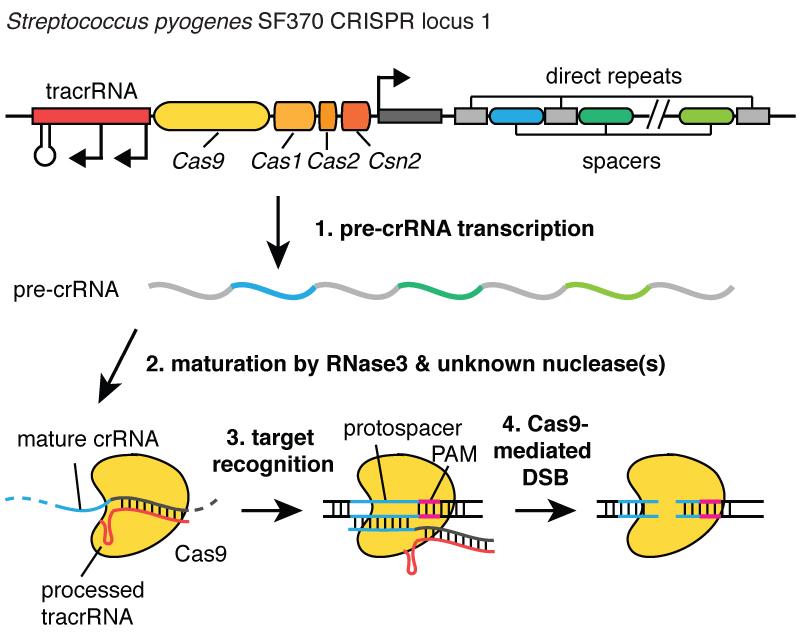
Когда вирусы инфицируют клетку, они впрыскивают свою ДНК. И внутри бактерии система CRISPR позволяет выдернуть эту ДНК из вируса и вставить её маленькие фрагменты в хромосому - в ДНК бактерии. И эти фрагменты вирусной ДНК вставляются в область, называемую CRISPR. CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами». (Смех)
03:24
Длинновато. Теперь вы понимаете, почему мы используем акроним CRISPR. Это механизм, позволяющий клеткам регистрировать с течением времени вирусы, которые их заражали. И важно отметить, что эти фрагменты ДНК передаются потомкам клеток, так что клетки защищены от вирусов не в течение одного поколения, а в течение многих поколений клеток. Это позволяет клеткам сохранять «записи» об инфекции, и как говорит мой коллега Блейк Виденхефт, локус CRISPR - это фактически карточка генетической вакцинации клеток. После встраивания этих фрагментов ДНК в бактериальную хромосому клетка делает маленькую копию в виде молекулы, называемой РНК, на этом рисунке она оранжевая, и это точный отпечаток вирусной ДНК. РНК - химическая «кузина» ДНК, что позволяет ей взаимодействовать с молекулами ДНК, имеющими подходящую для неё последовательность.
04:24
Итак, эти маленькие фрагменты РНК, образованные с локуса CRISPR, ассоциируют, связываются с белком под названием Cas9, на этом рисунке он белый, и образуется комплекс, который выполняет в клетке функции часового. Он просматривает всю ДНК в клетке, чтобы найти участки, соответствующие последовательностям связанных с ним РНК. И когда эти участки найдены, как можно видеть на рисунке, где ДНК - это синяя молекула, этот комплекс связывается с этой ДНК и даёт белку Cas9 разрезать вирусную ДНК. Он очень точно вносит разрыв. Мы можем рассматривать этого часового, комплекс белка Cas9 и РНК, как пару ножниц, которые могут разрезать ДНК, - он делает двуцепочечный разрыв в спирали ДНК. И важно, что этот комплекс можно запрограммировать, например, можно его запрограммировать узнавать нужные последовательности ДНК и разрезать ДНК в на этом участке.
05:26
Как я собираюсь вам рассказать, мы поняли, что эту активность можно использовать в генной инженерии, чтобы позволить клеткам вносить очень точные изменения в ДНК на участке, где был сделан данный разрез. Это примерно как использование программы, обрабатывающей слова, для исправления опечаток в документе.
05:48
Мы смогли предположить, что систему CRISPR можно использовать в геномной инженерии, поскольку клетки способны находить разорванную ДНК и восстанавливать её. Итак, когда клетка растения или животного находит двуцепочечный разрыв в своей ДНК, она способна его устранить, либо соединяя разорванные концы ДНК, внося незначительное изменение в последовательность в этом месте, либо она может устранить разрыв, вставив новый участок ДНК в место разрыва. Таким образом, если мы можем вносить двуцепочечные разрывы в ДНК в строго определённых местах, мы можем заставить клетки восстанавливать эти разрывы, при этом либо разрушая генетическую информацию, либо внося новую. И если бы мы смогли запрограммировать технологию CRISPR таким образом, чтобы разрыв в ДНК вносился в положении мутации или рядом с мутацией, вызывающей, например, муковисцидоз, мы могли бы заставить клетки исправить эту мутацию.
06:51
Вообще-то, геномная инженерия - не новая область, она развивается с 1970-х годов. У нас есть технологии для секвенирования ДНК, для копирования ДНК, даже для манипуляций с ДНК. И это весьма многообещающие технологии, но проблема в том, что они были либо неэффективны, либо слишком сложны в использовании, поэтому большинство учёных не могли использовать их в своих лабораториях или применять в клинических условиях. Таким образом, существовала потребность в такой технологии как CRISPR, потому что она относительно проста в использовании. Старые технологии геномной инженерии можно представить себе как необходимость перемонтировать ваш компьютер каждый раз, когда вы хотите запустить новую программу, тогда как технология CRISPR - это что-то вроде программного обеспечения для генома: мы легко можем её программировать, используя маленькие фрагменты РНК.
07:53
Как только сделан двуцепочечный разрыв, мы можем вызвать процесс восстановления и тем самым, возможно, достичь поразительных результатов, например, исправлять мутации, вызывающие серповидноклеточную анемию или болезнь Хантингтона. Лично я считаю, что первые случаи применения технологии CRISPR будут связаны с кровью, где относительно просто доставлять этот инструмент внутрь клеток, по сравнению с плотными тканями.
08:22
Прямо сейчас во многих проводимых работах метод применяют в животных моделях болезней человека, например, на мышах. Технологию используют для внесения очень точных изменений, что позволяет нам изучать то, как эти изменения клеточной ДНК влияют либо на ткань, либо, как здесь, на целый организм.
08:42
В этом примере технологию CRISPR использовали для разрушения гена путём внесения небольшого изменения в ДНК в гене, который отвечает за чёрную окраску шерсти этих мышей. Представьте, эти белые мышата отличаются от своих окрашенных братьев и сестёр всего только небольшим изменением одного гена во всём геноме, а в остальном они абсолютно нормальны. И когда мы секвенируем ДНК этих животных, то обнаруживаем, что изменение в ДНК произошло именно в том месте, где мы планировали, используя технологию CRISPR.
09:18
Также проводятся эксперименты и на других животных, у которых удобно создавать модели болезней человека, например, на обезьянах. И в этом случае мы обнаруживаем, что эти системы можно использовать для тестирования применения данной технологии к определённым тканям, например, для выяснения того, как доставлять инструмент CRISPR в клетки. Мы также хотим расширить наше понимание того, как можно контролировать способ восстановления ДНК после её разрыва, и выяснить, как можно контролировать и ограничивать нецелевое воздействие, или непреднамеренные эффекты, при использовании этой технологии.
09:55
Я полагаю, что мы станем свидетелями использования данной технологии в клинике, разумеется, у взрослых пациентов, в течение следующих 10 лет. Мне кажется вероятным, что за этот период будут проведены клинические исследования и, возможно, даже одобрены методы терапии, что очень воодушевляет. И благодаря этому воодушевлению, которое вызывает технология, к ней проявляют огромный интерес стартап-компании, созданные для того, чтобы превратить технологию CRISPR в коммерческий продукт, а также многие венчурные капиталисты,
10:26
инвестирующие в такие компании. Но мы также должны учитывать, что технологию CRISPR можно использовать для улучшения характеристик. Представьте, что мы могли бы попробовать конструировать людей, обладающих улучшенными характеристиками, например, более прочными костями, или меньшей склонностью к сердечно-сосудистым заболеваниям, или даже обладающих свойствами, которые, возможно, показались бы нам желательными, такими как другой цвет глаз или более высокий рост, что-то вроде этого. Если хотите, это «дизайнерские люди». Сейчас практически отсутствует генетическая информация, позволяющая понять, какие гены отвечают за эти признаки. Но важно понимать, что технология CRISPR дала нам инструмент для внесения таких изменений,
11:13
как только эти знания станут нам доступны. Это поднимает ряд этических вопросов, которые мы должны тщательно рассмотреть. И именно поэтому мы с коллегами призвали учёных всего мира сделать паузу в любых клинических применениях технологии CRISPR у эмбрионов человека, чтобы у нас было время тщательно рассмотреть все возможные последствия этого. И у нас есть важный прецедент для того, чтобы объявить такую паузу: в 1970-х годах учёные объединились для провозглашения моратория на использование молекулярного клонирования,
11:47
пока не будет тщательно проверена и подтверждена безопасность этой технологии. Так что пока генная инженерия людей откладывается, но это уже не научная фантастика. Созданные генной инженерией животные и растения уже существуют. И это накладывает на всех нас большую ответственность и необходимость учитывать как нежелательные последствия, так и роль преднамеренного влияния этого научного прорыва.
12:21
Спасибо!
12:22
(Аплодисменты) (Аплодисменты закончились)
Бруно Джуссани: Дженнифер, эта технология может иметь огромные последствия, как вы подчёркивали. Мы очень уважаем вашу позицию по объявлению паузы, или моратория, или карантина. У всего этого, конечно, есть терапевтические последствия, но есть и не связанные с лечением, и, по-видимому, именно они наиболее сильно притягивают интерес, особенно в СМИ. Вот один из последних выпусков журнала Economist: «Редактирование человечества». Здесь рассказывается только об улучшении свойств, не о лечении. Какую реакцию вы получили в марте от своих коллег в научном сообществе, когда попросили или предложили сделать паузу и задуматься обо всём этом?
Дженнифер Дудна: Мне кажется, коллеги были рады возможности открыто это обсудить. Интересно, что когда я разговаривала об этом с людьми, мои коллеги-учёные и не только высказывали самые разные точки зрения на этот счёт. Очевидно, что эта тема требует тщательного рассмотрения и обсуждения.
БДж: В декабре будет большая встреча, которую вы с коллегами созываете вместе с Национальной академией наук и другими. Чего именно вы ожидаете от этой встречи, с практической точки зрения?
ДжД : Я надеюсь, что будут обнародованы точки зрения многих людей и заинтересованных сторон, желающих ответственно обдумать использование этой технологии. Возможно, достигнуть консенсуса не удастся, но я полагаю, что мы должны по крайней мере понять, с какими проблемами столкнёмся в будущем.
БДж: Ваши коллеги, например, Джордж Чёрч из Гарварда, говорят: «Этические проблемы в основном являются вопросом безопасности. Мы снова и снова проводим тесты на животных, в лабораториях, и когда чувствуем, что опасности нет, переходим на человека». Это другой подход: мы должны использовать эту возможность и не должны останавливаться. Может ли это вызвать раскол в научном сообществе? То есть мы увидим, что часть людей отступят, потому что сомневаются в этичности, а другие просто пойдут вперёд, так как в некоторых странах контроль слабый или его вообще нет.
ДжД : Мне кажется, на любую новую технологию, особенно такую как эта, будет несколько разных точек зрения, и я думаю, что это абсолютно понятно. Полагаю, в конце концов эту технологию будут использовать для конструирования генома человека, но мне кажется, что делать это без тщательного рассмотрения и обсуждения рисков и возможных осложнений было бы безответственно.
БДж: Есть много технологий и других областей науки, которые развиваются по экспоненте, фактически как в вашей области. Я имею в виду искусственный интеллект, автономных роботов и так далее. Нигде, как мне кажется, кроме области автономных военных роботов, никто не инициировал аналогичную дискуссию в этих областях, призвав к мораторию. Не считаете ли вы, что ваша дискуссия может стать примером для других областей?
ДжД: Мне кажется, учёным сложно покидать лабораторию. Если говорить обо мне, мне не очень комфортно это делать. Но я действительно считаю, что раз я участвую в разработке этого, то данный факт накладывает на меня и моих коллег ответственность. И я бы сказала, что надеюсь, что другие технологии будут рассматриваться так же, как мы хотели бы рассматривать нечто, способное оказывать влияние в других областях, отличных от биологии.
15:44
БДж:
Дженнифер, спасибо за то, что пришли на TED.
ДжД : Спасибо!
Определенные химические маркеры в геноме человека изменяются в течение всей его жизни. Такое заключение сделала международная группа исследователей после анализа образцов ДНК одних и тех же людей, полученных с интервалом в несколько лет. Ученые опубликовали свою работу в журнале Journal of the American Medical Association .
Молекулы ДНК человека несут информацию обо всех особенностях его организма. Информацию, содержащуюся в геноме, можно условно разделить на два типа. Первый - это информация, закодированная в составных блоках ДНК - азотистых основаниях. Она передается по наследству и остается неизменной в течение жизни человека (если в ДНК не появляются случайные изменения - мутации). Информация второго типа определяется так называемыми эпигенетическими маркерами - химическими "надстройками" азотистых оснований. Наследование эпигенетических маркеров не подчиняется классическим законам генетики, однако они оказывают существенное влияние на функционирование генома.
До сих пор у ученых не было единого мнения относительно изменения эпигенетических маркеров ДНК в течение жизни человека. Исследователи под руководством Эндрю Фейнберга (Andrew Feinberg) из Университета Джона Хопкинса в Балтиморе изучали этот вопрос на примере одного из видов эпигенетической маркировки - метилирования. Ученые анализировали образцы ДНК 111 человек из Исландии, взятые в начале 1990-х и 2000-х годов. Во время отбора второй серии образцов добровольцам было 69 лет и больше. Чтобы исследовать рисунок метилирования, ученые использовали особый фермент, который режет определенную последовательность ДНК только в том случае, если она метилирована. Оценивая количество разрезов в "старых" и "новых" образцах ДНК, исследователи определяли разницу в уровне метилирования.
Оказалось, что у двух третей добровольцев уровень метилирования изменился как минимум на пять процентов. Приблизительно у трети исследованных людей "накопилось" около десяти процентов изменений. Интересно, что увеличение и уменьшение количества метильных групп в геноме наблюдалось одинаково часто. Чтобы понять, носит ли изменение профиля метилирования наследственный характер, ученые сравнили ДНК 126 человек из 21 американской семьи. Образцы ДНК отбирались с интервалом в 16 лет.
Результаты этих тестов оказались примерно такими же, как и результаты предыдущего эксперимента: у двух пятых из добровольцев уровень метилирования изменился на пять процентов и частота "прибавок" и "вычетов" метильных групп была примерно одинаковой. Однако у членов одной семьи преимущественно наблюдалось либо уменьшение либо увеличение числа метильных групп в геноме.
Авторы работы признают, что несмотря на всю важность полученных результатов, на сегодняшний день оценить их значение не представляется возможным. Эпигенетические изменения оказывают существенное воздействие на функционирование генома в целом, однако механизмы действия этих изменений пока весьма слабо изучены.
Первая операция по изменению ДНК в организме человека и человеческого эмбриона, точнейшие технологии редактирования генов на основе CRISPR и громкие истории излечения тяжелых наследственных заболеваний. О самых важных последних открытиях в генетике - в материале «Футуриста»
Важнейшее достижение в медицинской генетике - расширяющееся использование технологий редактирования генома человека как для изучения генетических механизмов, контролирующих ранние этапы развития эмбриона, патогенеза наследственных заболеваний, так и для коррекции генетических дефектов. От экспериментов на клеточных линиях и животных в прошлом году перешли к клиническим испытаниям редактирования генома для терапии наследственных болезней на человеке, рассказывает Вера Ижевская, доктор медицинских наук, заместитель директора по научной работе Медико-генетического научного центра РАН.
В США одобрили генную терапию на людях
В августе Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило генную терапию CAR-T против лейкемии у детей. Этот метод заключается в генетической модификации собственных клеток крови пациента. Врачи сначала собирают T-лимфоциты пациента, а затем в лаборатории перепрограммируют их. Затем клетки помещают обратно в тело, где они начинают активнее разрушать раковые клетки. Всего через два месяца ведомство одобрило еще одну CAR-T терапию, на этот раз предназначенную для лечения агрессивной неходжкинской лимфомы у взрослых.
И, наконец, в декабре было получено разрешение на использование Luxturna – терапии, направленной на модификацию одного конкретного гена непосредственно в теле пациента. Этот метод используется при лечении редкой формы унаследованной слепоты – врожденного амавроза Лебера. Это состояние вызывается мутацией в гене RPE65. В каждый глаз пациента вводится инъекция, которая доставляет правильную копию гена RPE65 непосредственно в клетки сетчатки. Однако это лечение очень дорогостоящее: аналитики подозревают , что одна процедура может стоить до 1 миллиона долларов. Подобные процедуры проводили в экспериментальном порядке в Великобритании еще в 2008 году. Тем не менее, одобрение метода на государственном уровне – значимое событие.
Генная терапия восстановила кожу семилетнего мальчика
Кожа ребенка с буллезным эпидермолизом
В ноябре итальянские исследователи объявили , что комбинация генной терапии и лечения с помощью стволовых клеток почти полностью восстановила кожу семилетнего мальчика, страдающего редким наследственным заболеванием – буллезным эпидермолизом. Оно вызывается мутациями в генах LAMA3, LAMB3 и LAMC2, которые отвечают за образование белка ламинина-332. В этом состоянии кожа и слизистые оболочки покрываются болезненными волдырями и становятся чувствительными к незначительным механическим повреждениям.
Исследователи взяли здоровые клетки кожи у пациента, и на их основе вырастили культуры кожи, в которые с помощью ретровирусов ввели здоровую копию гена LAMA3. Модифицированный ген попадал при этом в произвольное место, однако это не нарушило работу других генов. Затем трансгенную кожу привили ребенку на открытые участки дермы. В течение 21 месяца восстановилось около 80% его кожи.
По словам авторов исследования, прогнозы Хассана были очень плохими: он потерял почти весь эпидермис, был истощен и ему постоянно требовался морфин. В течение года перед началом эксперимента он питался через трубку, и поддержание его жизни стоило огромных усилий. Ему пытались пересадить кожу отца и использовать искусственные аналоги, но они не приживались. Сейчас мальчику 9 лет, он ходит в школу и чувствует себя хорошо. Это достижение свидетельствует о возможности лечения генетических заболеваний, которые считались неизлечимыми.
«Генные ножницы» стали гораздо точнее
Технологию CRISPR часто называют " генными ножницами" за ее способность вырезать и вставлять необходимые фрагменты ДНК легче, чем когда-либо прежде. Однако одним из главных препятствий на пути ее использования для лечения человеческих заболеваний являются так называемые внецелевые эффекты – непредусмотренные изменения в геноме после редактирования целевого участка. И все же эту технологию неуклонно совершенствуют. В 2017 году ученые объявили, что теперь с помощью CRISPR можно вносить изменения в РНК – для этого требуется белок Cas13.
Кроме того, в этом году стало широко известно о технологии, способной вносить точечные изменения в ДНК и РНК вместо того, чтобы вырезать и заменять целые фрагменты. Геном человека содержит шесть миллиардов химических оснований – A (аденин), C (цитозин), G (гуанин) и T (тимин). Эти буквы соединяются попарно (A с T, а C с G), образуя двойную спираль ДНК. Стандартные методы редактирования генома, в том числе CRISPR-Cas9, делают двухцепочечные разрывы в ДНК. Однако это слишком грубое решение проблемы, особенно в случаях, когда необходимо исправить точечную мутацию.Технология базового редактирования (ABE) предлагает более эффективный и чистый вариант: она позволяет точечно заменить одну букву в паре на другую. Белок Cas, в технологии CRISPR разрезающий нити ДНК, теперь просто прикрепляется к нужному месту цепочки и приносит с собой другой белок, меняющий одну генетическую букву на другую. ABE не заменяет технологию CRISPR, а является альтернативным вариантом на случай, если требуется внести более тонкие изменения в геном.
ДНК отредактировали прямо в организме человека

Брайан Мадо с невестой перед операцией
В ноябре американские ученые впервые ДНК прямо в теле пациента. Как правило, методы лечения, затрагивающие генетику пациента, основываются на манипуляциях вне человеческого тела. Но в этот раз была использована капельница, которая доставила миллиарды копий корректирующего гена в тело пациента вместе с генетическим инструментом, разрезающим ДНК в нужном месте и освобождающим место для нового гена.
44-летний Брайан Мадо страдает синдромом Хантера – метаболическим заболеванием, при котором углеводы накапливаются в организме из-за недостатка определенных ферментов. До этого эксперимента мужчина перенес уже 26 операций. О результатах процедуры можно будет судить через несколько месяцев: в случае успеха его организм сможет производить необходимый фермент самостоятельно, и ему не придется проходить еженедельную терапию.
"После этого биотехнологическая компания Sangamo Therapeutics начала набор участников клинических испытаний этого метода с гемофилией B, синдромом Гурлера и синдромом Хантера. В случае успешных клинических испытаний появляется надежда на появление эффективных методов лечения наследственных заболеваний, прежде считавшихся неизлечимыми", - комментирует Вера Ижевская.
Первые операции по изменению ДНК эмбриона человека
В сентябре в Китае провели первую в мире операцию по редактированию генома человеческого эмбриона. Исследователи использовали упомянутую выше технологию редактирования базовых оснований ДНК, чтобы излечить бета-талассемию - заболевание, при котором нарушается синтез гемоглобина. Операция проводилась на синтезированных в лаборатории эмбрионах. Чуть позже об экспериментах по редактированию генома эмбриона рассказали шведские ученые.
"Одной из наиболее впечатляющих работ по изменению генома человека является исследование международной группы ученых в США, под руководством Шухрата Миталипова, сообщивших об успешном исправлении мутации гена MYBPC3, приводящей к гипертрофической кардиомиопатии, при редактировании гена эмбрионов человека", - комментирует Вера Ижевская.
Ранее эксперименты проводились на зародышах мышей. Это исследование пролило свет на потенциальное решение проблемы мозаицизма – наличие в тканях генетически различающихся клеток. Если у эмбриона есть две разные копии одного и того же гена, и впоследствии какие-то клетки получают нормальную версию, а какие-то – мутантную, что ведет к различным заболеваниям. Опыты показали, что если ввести CRISPR/Cas-редактор почти одновременно с оплодотворением, то этого можно избежать.
Генетическое тестирование
Одним из ярких инфоповодов уходящего года стала история биохакера Сергея Фаге , который утверждал, что он контролирует свое состояние, опираясь на результаты генетического тестирования. Однако эта методика очень противоречива. Исследование генома человека для определения его происхождения, склонности к тому или иному виду спорта и т.д., - относится к так называемой развлекательной генетике. Их проведение не требует специальной медицинской лицензии, как правило они выполняются коммерческими компаниями. Однако нередко на рынке предлагаются генетические тесты для подтверждения наследственного заболевания у больного, выявления мутаций, которые могут вызвать наследственное заболевание у обследуемого или его детей, тестирования предрасположенности к различным болезням.
"Здесь следует иметь в виду, что современные технологии анализа генома эффективны в первых двух случаях, касающихся мутаций, которые вызывают редкие наследственные заболевания. Что касается тестирования предрасположенности к частым заболеваниям (сердечно-сосудистым, диабету и т.д.), то они имеют невысокое прогностическое значение и их результаты часто сопровождаются общими рекомендациями о необходимости вести здоровый образ жизни. В любом случае, генетическое тестирование с медицинскими целями должно быть назначено врачом, до него пациенту должно быть врачом-генетиком объяснено, что он может получить в результате тестирования, заключение также дает врач-генетик. Из этого следует, что учреждение, которое выполняет такие тесты, должно иметь медицинскую лицензию по специальностям "генетика" и "лабораторная генетика" и соответствующий штат квалифицированных специалистов", - объясняет Вера Ижевская.
Что делать пациенту с этой дорогостоящей информацией, далеко не всегда понятно.