Ковалентная хим связь. Что такое ковалентная связь – полярная и неполярная
Ковалентная связь (атомная связь, гомеополярная связь) - химическая связь, образованная перекрытием (обобществлением) парывалентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой .
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома.
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H 2 . Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
· Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества, например: О 2 , N 2 , Cl 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
· Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называетсяковалентной полярной связью .
2. Донорно-акцепторная связь . Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов - донор . Второй из атомов, участвующий в образовании связи, называется акцептором . В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь . Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами - в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
σ-связь и π-связь
Сигма (σ)-, пи (π)-связи - приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют -связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две -связи между этими же атомами углерода. Две -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные -связи, а единая -электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Примеры веществ с ковалентной связью
Простой ковалентной связью соединены атомы в молекулах простых газов (Н 2 , Cl 2 и др.) и соединений (Н 2 О, NH 3 , CH 4 , СО 2 , HCl и др.). Соединения с донорно-акцепторной связью -аммония NH 4 + , тетрафторборат анион BF 4 − и др. Соединения с семиполярной связью - закись азота N 2 O, O − -PCl 3 + .
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
Ионная связь - очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. - l е -> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь - крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов,
Количественные характеристики химических связей. Энергия связи. Длина связи. Полярность химической связи. Валентный угол. Эффективные заряды на атомах в молекулах. Дипольный момент химической связи. Дипольный момент многоатомной молекулы. Факторы, определяющие величину дипольного момента многоатомной моле-кулы.
Характеристики ковалентной связи . Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи - расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи (m) - векторная величина, характеризующая полярность связи.
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
На характеристики связей влияет их кратность :
Энергия связи увеличивается в ряд;
Длина связи растет в обратном порядке.
Энергия связи (для данного состояния системы) — разность между энергией состояния, в котором составляющие части системы бесконечно удалены друг от друга и находятся в состоянии активного покоя и полной энергией связанного состояния системы: ,
где E — энергия связи компонентов в системе из N компонентов (частиц), Еi — полная энергия i-го компонента в несвязанном состоянии (бесконечно удалённой покоящейся частицы) и E — полная энергия связанной системы. Для системы, состоящей из бесконечно удалённых покоящихся частиц энергию связи принято считать равной нулю, то есть при образовании связанного состояния энергия выделяется. Энергия связи равна минимальной работе, которую необходимо затратить, чтобы разложить систему на составляющие её частицы.
Она характеризует стабильность системы: чем выше энергия связи, тем система стабильнее. Для валентных электронов (электронов внешних электронных оболочек) нейтральных атомов в основном состоянии энергия связи совпадает с энергией ионизации, для отрицательных ионов — со сродством к электрону. Энергии химической связи двухатомной молекулы соответствует энергия её термической диссоциации, которая составляет порядка сотен кДж/моль. Энергия связи адронов атомного ядра определяется в основном сильным взаимодействием. Для лёгких ядер она составляет ~0,8 МэВ на нуклон.
Длина химической связи — расстояние между ядрами химически связанных атомов. Длина химической связи — важная физическая величина, определяющая геометрические размеры химической связи, её протяжённость в пространстве. Для определения длины химической связи используют различные методы. Газовую электронографию, микроволновую спектроскопию , спектры комбинационного рассеяния и ИК спектры высокого разрешения применяют для оценки длины химических связей изолированных молекул в паровой (газовой) фазе. Считается, что длина химической связи является аддитивной величиной, определяемой суммой ковалентных радиусов атомов, составляющих химическую связь.
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Можно количественно оценить полярность связи в молекуле. Трудность точной количественной оценки состоит в том, что полярность связи зависит от нескольких факторов: от размеров атомов и ионов соединяющихся молекул; от числа и характера связи уже имевшихся у соединяющихся атомов до их данного взаимодействия; от типа структуры и даже особенностей дефектов их кристаллических решёток. Такого рода расчёты производятся различными методами, которые в общем-то дают примерно одинаковые результаты (величины).
Например, для HCl установлено, что на каждом из атомов в этой молекуле имеется заряд, равный 0,17 заряда целого электрона. На водородном атоме +0,17, а на атоме хлора −0,17. В качестве количественной меры полярности связи чаще всего используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный [относительный] смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Валентный угол — угол, образованный направлениями химических (ковалентных) связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путем анализа их вращательных спектров. Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА, характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в к-рых экспериментально определяемые величины представляют как функции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии.
Дипольные моменты молекул.
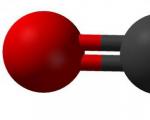
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Характеристикой полярности связи служит ее дипольный момент.
Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей. Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода . Многоатомные молекулы с несимметричным расположением полярных связей являются в целом полярными. Это относится, в частности, к молекуле воды.

На результирующее значение дипольного момента молекулы может повлиять неподеленная пара электронов. Так, молекулы NH3 и NF3 имеют тетраэдрическую геометрию (с учетом неподеленной пары электронов). Степени ионности связей азот − водород и азот − фтор составляют 15 и 19%, соответственно, а их длины - 101 и 137 пм, соответственно. Исходя из этого, можно было бы сделать вывод о большем дипольном моменте NF3. Однако эксперимент показывает обратное. При более точном предсказании дипольного момента следует учитывать направление дипольного момента неподеленной пары (рис. 29).


Концепция гибридизации атомных орбиталей и пространственное строение молекул и ионов. Особенности распределения электронной плотности гибридных орбиталей. Основные типы гибридизации: sp, sp2, sp3, dsp2, sp3d, sp3d2. Гибридизация с участием неподеленных электронных пар.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ.
Для объяснения строения некоторых молекул в методе ВС применяется модель гибридизации атомных орбиталей (АО). У некоторых элементов (бериллий, бор, углерод) в образовании ковалентных связей принимают участие как s-, так и p-электроны. Эти электроны расположены на АО, различающихся по форме и энергии. Несмотря на это связи, образованные с их участием, оказываются равноценными и расположены симметрично.
В молекулах ВеС12, ВС13 и СС14, например, валентный угол С1-Э-С1 равен 180, 120, и 109.28 о. Значения и энергии длин связей Э-С1 имеют для каждой из этих молекул одинаковое значение. Принцип гибридизации орбиталей состоит в том, что исходные АО разной формы и энергии при смешении дают новые орбитали одинаковой формы и энергии. Тип гибридизации центрального атома определяет геометрическую форму молекулы или иона, образованного им.
Рассмотрим с позиций гибридизации атомных орбиталей строение молекулы. 
Пространственная форма молекул .
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна: химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be-Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:

Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.
Другой пример: в молекуле BF3 имеется 3 связи B-F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120 о:

Гибридизация атомных орбиталей.
В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары . Например, молекула воды содержит две ковалентные химические связи между атомом кислорода и рисунок 21 двумя атомами водорода (рис. 21).

Помимо двух пар электронов, общих с атомами водорода, у атома кислорода имеются две пары внешних электронов, не участвующих в образовании связи (неподеленные электронные пары). Все четыре пары электронов занимают определенные области в пространстве вокруг атома кислорода. Поскольку электроны отталкиваются друг от друга, электронные облака располагаются на возможно большем расстоянии друг от друга. При этом в результате гибридизации меняется форма атомных орбиталей, они вытянуты и направлены к вершинам тетраэдра. Поэтому молекула воды имеет угловую форму, а угол между связями кислород-водород равен 104,5 o.






Форма молекул и ионов типа АВ2, АВ3, АВ4, АВ5, АВ6. d-АО, участвующие в образовании σ-связей в плоских квадратных молекулах, в октаэдрических молекулах и в молекулах, построенных в форме тригональной бипирамиды. Влияние отталкивания электронных пар на пространственную конфигурацию молекул (концепция участия неподеленных электронных пар КНЭП).
Форма молекул и ионов типа АВ2, АВ3, АВ4, АВ5, АВ6 . Каждому виду гибридизации АО соответствует строго определенная геометрическая форма, подтвержденная экспериментально. Ее основу создают σ-связи, образованные гибридными орбиталями, в их электростатическом поле движутся делокализованные пары π-электронов (в случае кратных связей) (табл. 5.3). sp-гибридизация . Подобный тип гибридизации возникает при образовании атомом двух связей за счет электронов, находящихся на s- и p-орбиталях и обладающих близкой энергией. Этот тип гибридизации характерен для молекул типа АВ2(рис. 5.4). Примеры таких молекул и ионовприведены в табл. 5.3 (рис. 5.4).
Таблица 5.3
Геометрические формы молекул

Е - неподеленная электронная пара.
Структура молекулы BeCl2. Атом бериллия имеет в нормальном состоянии во внешнем слое два спаренных s-электрона. В результате возбуждения один из s электронов переходит в p-состояние - появляются два неспаренных электрона, отличающиеся формой орбитали и энергией. При образовании химической связи они преобразуются в две одинаковые sp-гибридные орбитали, направленные под углом 180 градусов друг к другу.
Be 2s2 Be 2s1 2p1 - возбужденное состояние атома

Рис. 5.4. Пространственное расположение sp-гибридных облаков
Основные виды межмолекулярных взаимодействий. Вещество в конденсированном состоянии. Факторы, определяющие энергию межмолекулярных взаимодействий. Водородная связь. Природа водородной связи. Количественные характеристики водородной связи. Меж- и внутримолекулярная водородная связь.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ - взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. М. в. определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От М. в. зависят мн. структурные, спектральные, термодинамич. и др. св-ва в-в. Появление понятия М. в. связано с именем Ван-дер-Ваальса , к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее М. в. Поэтому силы М. в. часто называют ван-дер-ваальсовыми.
Основу М. в. составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненное взаимод., которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы М. в. можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатичные силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац. силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды М. в. можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на нек-рую условность, такое деление в каждом конкретном случае позволяет объяснять природу М. в. и рассчитать его энергию.
Строение вещества в конденсированном состоянии.
В зависимости от расстояния между частицами, составляющими вещество, и от характера и энергии взаимодействия между ними вещество может находиться в одном из трех агрегатных состояний: в твердом, жидком и газообразном.
При достаточно низкой температуре вещество находится в твердом состоянии. Расстояния между частицами кристаллического вещества составляют порядка размера самих частиц. Средняя потенциальная энергия частиц больше их средней кинетической энергии. Движение частиц, составляющих кристаллы, весьма ограниченно. Силы, действующие между частицами, удерживают их в близи равновесных положений. Этим объясняется наличие у кристаллических тел собственных формы и объема и большое сопротивление сдвигу.
При плавлении твердые вещества переходят в жидкость. По структуре жидкое вещество отличается от кристаллического тем, что не все частицы находятся друг от друга на тех же расстояниях, что и в кристаллах, часть молекул отдалена друг от друга на большие расстояния. Средняя кинетическая энергия частиц для веществ в жидком состоянии примерно равна их средней потенциальной энергии.
Твердое и жидкое состояния часто принято объединять общим термином - конденсированное состояние.
Типы межмолекулярных взаимодействий внутримолекулярная водородная связь. Связи, при образовании которых перестройка электронных оболочек не происходит, называются взаимодействием между молекулами . К основным видам взаимодействия молекул следует отнести ван-дер-ваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
При сближении молекул появляется притяжение, что обуславливает возникновение конденсированного состояния вещества (жидкого, твердого с молекулярной кристаллической решеткой). Силы, которые способствуют притяжению молекул, получили название ван-дер-ваальсовых.
Они характеризуются тремя видами межмолекулярного взаимодействия :
а) ориентационное взаимодействие, которое проявляется между полярными молекулами, стремящимися занять такое положение, при котором их диполи были бы обращены друг к другу разноименными полюсами, а векторы моментов этих диполей были бы ориентированы по одной прямой (по-другому оно называется диполь-дипольное взаимодействие);
б) индукционное, которое возникает между индуцированными диполями, причина образования которых является взаимная поляризация атомов двух сближающихся молекул;
в) дисперсионное, которое возникает в результате взаимодействия микродиполей, образующихся за счет мгновенных смещений положительных и отрицательных зарядов в молекулах при движении электронов и колебаний ядер.
Дисперсионные силы действуют между любыми частицами. Ориентационное и индукционное взаимодействие для частиц многих веществ, например: He, Ar, H2, N2, CH4, не осуществляется. Для молекул NH3 на дисперсионное взаимодействие приходится 50 %, на ориентационное - 44,6 % и на индукционное - 5,4 %. Полярная энергия вандерваальсовых сил притяжения характеризуется невысокими значениями. Так, для льда она составляет 11 кДж/моль, т.е. 2,4 % энергии ковалентной связи H-O (456 кДж/моль). Вандерваальсовы силы притяжения - это физические взаимодействия.
Водородная связь - это физико-химическая связь между водородом одной молекулы и ЭО элементом другой молекулы. Образование водородных связей объясняется тем, что в полярных молекулах или группах поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой ЭО и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома. Как показывают спектральные данные, в образовании водородной связи существенную роль играет также и донорно-акцепторное взаимодействие ЭО атома как донора и атома водорода как акцептора. Водородная связь может быть межмолекулярной или внутримолекулярной.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Так, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями. Водородная связь имеет промежуточный характер между валентным и межмолекулярным взаимодействием. Она связана с уникальными свойствами поляризованного атома водорода, его малыми размерами и отсутствием электронных слоев.
Межмолекулярная и внутримолекулярная водородная связь.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:

а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
Периодический закон. Современная формулировка периодического закона. Периодическая система химических элементов - графическая иллюстрация периодического закона. Современный вариант Периодической системы. Особенности заполнения электронами атомных орбиталей и формирование периодов. s-, p-, d-, f- Элементы и их расположение в периодической системе. Группы, периоды. Главные и побочные подгруппы. Границы периодической системы.
Открытие Периодического закона.
Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно. В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl, бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь .
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными . Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s- орбитали и 1 на 2p -орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl 4 , H 2 S, CO 2 , NH 3 , SiO 2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH 4 + :
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом , а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом .
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:

Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F − , Cl − , S 2-), а также между простыми катионами и сложными анионами (NO 3 − , SO 4 2- , PO 4 3- , OH −). Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH)
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М 0 — ne − = M n + ,
где М 0 – нейтральный атом металла, а M n + катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Химическая связь - электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов - s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи - среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи - количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол - угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная .
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью . Эта связь существует, например, в молекулах H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , I 2 . Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F 2 , Cl 2 , Br 2 , I 2 , три - в молекуле азота N 2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H 2 S, N 2 O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга . Примеры соединений с ионной связью: NaCl, KBr, Na 2 O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
1) O 2 , H 2 , N 2
2) Al, O 3 , H 2 SO 4
3) Na, H 2 , NaBr
4) H 2 O, O 3 , Li 2 SO 4
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
1) O 2 , H 2 SO 4 , N 2
2) H 2 SO 4 , H 2 O, HNO 3
3) NaBr, H 3 PO 4 , HCl
4) H 2 O, O 3 , Li 2 SO 4
3. Только ионной связью образовано каждое из веществ, формулы которых
1) CaO, H 2 SO 4 , N 2
2) BaSO 4 , BaCl 2 , BaNO 3
3) NaBr, K 3 PO 4 , HCl
4) RbCl, Na 2 S, LiF
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
1) HCl и Na 2 S
2) Cr и Al(OH) 3
3) NaBr и P 2 O 5
4) P 2 O 5 и CO 2
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
1) HI – PH 3 – HCl
2) PH 3 – HCl – H 2 S
3) HI – HCl – H 2 S
4) HCl – H 2 S – PH 3
11. Длина химической связи Э–Н уменьшается в ряду веществ
1) NH 3 – H 2 O – HF
2) PH 3 – HCl – H 2 S
3) HF – H 2 O – HCl
4) HCl – H 2 S – HBr
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, -
1) 4
2) 2
3) 6
4) 8
13. Число электронов, которые участвуют в образовании химических связей в молекуле P 2 O 5 , -
1) 4
2) 20
3) 6
4) 12
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
1) Mg
2) H 2
3) NaCl
4) CaCl 2
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
1) NaF, CaF 2
2) NaNO 3 , N 2
3) O 2 , SO 3
4) Ca(NO 3) 2 , AlCl 3
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Вконтакте
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами . Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов .
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы;
- спирты;
- углеводы;
- белки;
- органические кислоты.
Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
 Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц
, присутствующих в формуле.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц
, присутствующих в формуле.
Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
- фосфора и ;
- хлора и ;
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами с разными показателями электроотрицательности. В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
Формула вещества с ковалентной полярной связью – это:
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
 Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном. Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи , как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности. Другими словами, вещества с ковалентной неполярной связью — это соединения, состоящие из разного количества идентичных неметаллов.
Формула вещества с ковалентной неполярной взаимосвязью:
 Примеры соединений, относящиеся к указанной категории являются веществами простого строения
. В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
Примеры соединений, относящиеся к указанной категории являются веществами простого строения
. В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Свойства веществ с описанными структурами существенно различаются от свойств веществ с металлической либо ионной взаимосвязью.
Что такое ковалентная полярная связь
Какие бывают виды химической связи