Физические и химические свойства серы. Что такое пластическая сера
ОПРЕДЕЛЕНИЕ
Сера – элемент 3 периода VIA группы, относится к семейству p-элементов. Порядковый номер 16.
Электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 4 . Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67С, плавления – 112,85С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F 2 = SF 6 ;
2S + Cl 2 = S 2 Cl 2 ;
S + Cl 2 = SCl 2 ;
5S + 2P = P 2 S 5 ;
S + H 2 = H 2 S;
S + O 2 = SO 2 ;
2S + Br 2 = S 2 Br 2 .
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na 2 S;
2Al + 3S = Al 2 S 3 ;
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K 2 SO 3 +2K 2 S + 3H 2 O;
S + 6HNO 3 = H 2 SO 4 + 6NO 2 + 2H 2 O;
S + 2H 2 SO 4 = 3SO 2 + 2H 2 O.
При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na 2 S + S = Na 2 S 2 .
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S 8 . Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.

Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
ПРИМЕР 1
Cера в природе
Самородная сера
Украина, Поволжье, Центральная Азия и др
Сульфиды
PbS - свинцовый блеск
Cu 2 S – медный блеск
ZnS – цинковая обманка
FeS 2 – пирит, серный колчедан, кошачье золото
H 2 S – сероводород (в минеральных источниках и природном газе)
Белки
Волосы, кожные покровы, ногти…
Сульфаты
CaSO 4 x 2 H 2 O - гипс
MgSO 4 x 7 H 2 O – горькая соль (английская)
Na 2 SO 4 x 10 H 2 O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета , нерастворима в воде, водой не смачивается (плавает на поверхности), t ° кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
|
Ромбическая (a - сера) - S 8 t ° пл. = 113° C ; ρ = 2,07 г/см 3 . Наиболее устойчивая модификация. |
Моноклинная (b - сера) - S 8 темно-желтые иглы, t ° пл. = 119° C ; ρ = 1,96 г/см3. Устойчивая при температуре более96°С; при обычных условиях превращается в ромбическую. |
Пластическая S n коричневая резиноподобная (аморфная) масса.Неустойчива, при затвердевании превращается в ромбическую. |
|
|
|
|
c остальными металлами (кроме Au , Pt ) - при повышенной t ° : 2Al + 3S – t ° -> Al 2 S 3 Zn + S – t
°->
ZnS ОПЫТ Cu + S – t
°->
CuS ОПЫТ 2) С некоторыми неметаллами сера образует бинарные соединения: H 2 + S -> H 2 S 2P + 3S -> P 2 S 3 C + 2S -> CS 2 |
1) c кислородом: S + O 2 – t ° -> S +4 O 2 2S + 3O 2 – t ° ; pt -> 2S +6 O 3 2) c галогенами (кроме йода): S + Cl 2 -> S +2 Cl 2 3) c кислотами - окислителями: S + 2H 2 SO 4 (конц) -> 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц) -> H 2 S +6 O 4 + 6NO 2 + 2H 2 O Применение Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д. Применение серы и её соединений ЗАДАНИЯ №1. Закончите уравнения реакций:S + O 2 S + Na S + H 2 Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель. №2. Осуществите превращения по схеме: №3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S =(при нагревании) S + H 2 = (150-200) S + O 2 = (при нагревании) S + F 2 = (при обычных условиях) S + H 2 SO 4 (к) = S + KOH = S + HNO 3 =Это интересно... Содержание серы в организме человека массой 70 кг - 140 г. В сутки человеку необходимо 1 г серы. Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго. Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос. Следите за своим здоровьем! Знаете ли вы... ·Соединения серы могут служить лекарственными препаратами ·Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na 2 S 2 O 3 используется для борьбы с нею ·Многие соли серной кислоты содержат кристаллизационную воду: ZnSO 4 ×7H 2 O и CuSO 4 ×5H 2 O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства ·Железный купорос FeSO 4 ×7H 2 O используют при анемии ·BaSO 4 применяют при рентгенографическом исследовании желудка и кишечника ·Алюмокалиевые квасцы KAI(SO 4) 2 ×12H 2 O - кровоостанавливающее средство при порезах ·Минерал Na 2 SO 4 ×10H 2 O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na 2 SO 4 ×10H 2 O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла ·Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями ·Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания. |
Сера - элемент 6-й группы (по устаревшей систематизации - главной подгруппы VI группы), третьего периода повторяющейся системы хим частей Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические характеристики. Обозначается эмблемой S (лат. Sulfur). В водородных и кислородных соединениях находится в составе разных ионов, образует многие кислоты и соли. Многие серосодержащие соли плохорастворимы в воде.
Природные минералы серы
Сера является шестнадцатым по хим распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.
Важные природные соединения серы: FeS2 - металлический колчедан либо пирит, ZnS - цинковая обманка либо сфалерит (вюрцит), PbS - свинцовый сияние либо галенит, HgS - киноварь, Sb2S3 - антимонит. Не считая того, сера находится в нефти, природном угле, природных газах и сланцах. Сера - 6-ой элемент по содержанию в природных водах, встречается в главном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Актуально принципиальный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
История открытия
Сера (англ. Sulfur, фр. Soufre, нем. Schwefel) в самородном состоянии, также в виде сернистых соединений известна с древних времён. С запахом пылающей серы, удушающим действием сернистого газа и мерзким запахом сероводорода человек познакомился, возможно, ещё в доисторические периоды. Конкретно из-за этих параметров сера использовалась жрецами в составе священных курений при религиозных ритуалах. Сера числилась произведением сверхчеловеческих созданий из мира духов либо подземных богов. Очень издавна сера стала применяться в составе разных горючих консистенций для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений пылающей серы. Сера, возможно, заходила в состав «греческого огня», наводившего кошмар на врагов. Около VIII в. китайцы стали применять её в пиротехнических консистенциях, а именно, в консистенции класса пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (к примеру, на поверхности кусков металла), разъясняют то, что её считали «принципом горючести» и неотклонимой составной частью железных руд. Пресвитер Теофил (XII в.) обрисовывает метод окислительного обжига сульфидной медной руды, узнаваемый, возможно, ещё в древнем Египте. В период арабской алхимии появилась ртутно-серная теория состава металлов, согласно которой сера почиталась неотклонимой составной частью (папой) всех металлов. В предстоящем она стала одним из трёх принципов алхимиков, а позже «принцип горючести» явился основой теории флогистона. Простую природу серы установил Лавуазье в собственных опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, также разработка метода получения её из пиритов; последний был распространён в древней Руси. В первый раз в литературе он описан у Агриколы. Следовательно, точно происхождение серы не установлено, однако, как сказано выше, этот элемент употреблялся до Рождества Христова, а означает знаком людям с давнешних времён.
Происхождение наименования
Российское заглавие серы всходит к праславянскому *sera, которое связывают с лат. serum «сыворотка».
Латинское sulphur (эллинизированное написание более старенького sulpur) всходит к индоевропейскому корню *swelp - «гореть».
Физические характеристики
Сера значительно отличается от кислорода способностью создавать устойчивые вереницы и циклы из атомов. Более размеренны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера - хрупкое вещество жёлтого цвета. Не считая того, вероятны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Таковой состав имеет пластическая сера, вещество кофейного цвета, которая выходит при резком охлаждении расплава серы (пластическая сера уже через немного часов становится хрупкой, приобретает жёлтый цвет и равномерно преобразуется в ромбическую). Формулу серы в большинстве случаев записывают просто S, потому что она, хотя и имеет молекулярную структуру, является консистенцией обычных веществ с различными молекулами. В воде сера нерастворима, некие её модификации растворяются в органических растворителях, к примеру сероуглероде, скипидаре. Плавление серы сопровождается приметным повышением объёма (приблизительно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C преобразуется в очень вязкую тёмно-коричневую массу. Самую большую вязкость расплав серы приобретает при температуре 190 °C; предстоящее увеличение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера опять становится подвижной. Это связано с тем, что при нагревании серы она равномерно полимеризуется, увеличивая длину вереницы с увеличением температуры. При нагревании серы выше 190 °C полимерные звенья начинают рушиться. Сера может служить простым примером электрета. При трении сера приобретает сильный отрицательный заряд.
Серу используют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная - фармацевтический продукт. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента - для получения серобетона.
Исследовательское обучение
в практике преподавания химии
Ч еловек по своей природе – исследователь. Особенно ярко поисковая активность проявляется в юном возрасте, когда небольшой жизненный опыт не дает возможности получить ответы на все интересующие вопросы.
Учитель может использовать это природное стремление к поиску в своей образовательной деятельности, координируя переход от спонтанного интереса учащихся к природным объектам и явлениям к конструктивным, сознательным, логически выверенным действиям . Цель такой работы – формирование ключевых компетенций учащихся: образовательной, методологической, коммуникативной, экспериментальной. Исследовательский метод особенно эффективен в практике обучения химии, т.к. он дополняется школьным экспериментом.
Существует масса методических приемов и дидактических методов, позволяющих вовлекать учащихся в исследовательскую деятельность. Можно организовать эту работу, комбинируя объяснительно-иллюстративный метод обучения с эвристическим методом, проводя лабораторные и практические работы исследовательского характера, развивая навыки творческой работы с литературными источниками.
Сущность эвристического метода обучения предлагается рассмотреть на примере урока в 8-м классе по теме «Периодический закон и периодическая система химических элементов Д.И.Менделеева». На первом этапе изучения темы учащиеся делают карточки со знаками химических элементов, изображая знаки металлов черным, неметаллов – красным цветом. На этих карточках указываются относительные атомные массы элементов, важнейшие характеристики как простых веществ, образованных атомами этих элементов, так и их соединений: оксидов и гидроксидов.
На следующем этапе учащиеся раскладывают эти карточки по мере увеличения атомных масс в один ряд, самостоятельно замечая в ходе работы периодичность в изменении свойств простых веществ и кислотно-основных характеристик соединений химических элементов. Чаще всего далее следует предложение разделить общий ряд карточек на самостоятельные подразделения, которые начинаются со щелочного металла и заканчиваются инертным газом. Так мы получаем периоды периодической системы химических элементов (ПСХЭ), даем им определение, отмечаем закономерности изменения физико-химических свойств простых веществ и соответствующих соединений.
Сформировав таким способом несколько периодов химических элементов, ребята понимают, что в столбцах друг под другом располагаются элементы со сходными характеристиками. В результате мы «открываем» группы ПСХЭ, даем им определение, отмечаем наличие главных и побочных подгрупп, закономерности изменения химических свойств в подгруппах.
Таким образом, в сущности мы моделируем логику Д.И.Менделеева по открытию периодического закона.
Для учащихся старших классов аналогичный метод может быть применен в усложненном виде: периодический закон формулируется, ПСХЭ формируется в свете теории строения атомов, прослеживаются закономерности изменения количества элементарных частиц, атомного радиуса .
П ри обучении органической химии эвристический метод может быть применен после освоения учащимися таких понятий, как «кратные связи», «предельные и непредельные соединения», «функциональные группы», «качественные реакции».
Исследование зависимости свойств бензола от его химического строения начинают с противоречия: согласно формуле Ф.А.Kекуле бензол должен проявлять свойства непредельных углеводородов, т. е. взаимодействовать с бромной водой и водным раствором перманганата калия, но эти реакции не наблюдаются. Дальнейшее изучение строения молекулы бензола показывает, что единое p-облако электронов выравнивает связи по всему бензольному кольцу, и для этого представителя ароматических углеводородов более характерны реакции замещения . Такой проблемный способ решения учебной задачи позволяет следовать логике научного познания, приводит к качественному усвоению учебного материала.
При изучении строения глюкозы в курсе органической химии логика объяснения нового материала может быть обратная (от свойств – к строению): учащиеся проводят реакции раствора глюкозы с аммиачным раствором оксида серебра и раствора глюкозы со свежеприготовленным осадком гидроксида меди(II) при комнатой температуре. Первая реакция («серебряное зеркало») свидетельствует о наличии карбонильной группы, вторая – о присутствии нескольких гидроксигрупп в молекуле глюкозы. Далее учитель поясняет, что 1 моль глюкозы вступает в реакцию этерификации с 5 моль уксусного ангидрида (СН 3 СО) 2 О. Следовательно, гидроксигрупп – пять. Таким образом, мы доказываем, что глюкоза – это альдегидоспирт. Тривиальное задание для учащихся по школьному пособию можно превратить в увлекательное исследование неизвестной ранее информации. Учителю достаточно использовать несколько методических приемов: мотивировать процесс работы с учебным материалом, научить выбирать нужную информацию и фиксировать ее в компактном виде (таблицы, схемы). Очень важно заронить в этот процесс зерно конкуренции: самая подробная таблица, рациональная схема, логически выверенная цепочка должны быть отмечены по окончании работы.
При изучении в 9-м классе темы «Сера» учащимся предварительно демонстрируется ромбическая сера до нагревания, процесс плавления кристаллической серы и получившаяся в результате коричневая жидкость, представляющая собой пластическую серу. Далее предлагается заполнить сводную таблицу «Сравнительная характеристика аллотропных модификаций серы», используя материал учебного пособия .
Таблица
Сравнительная характеристика аллотропных модификаций серы
| Вопросы характеристики | Ромбическая сера | Пластическая сера |
|---|---|---|
| Химическая формула | S 8 | S n |
| Физические свойства | Лимонно-желтые полупрозрачные кристаллы с t пл = 112,8 °С. Нерастворима в воде, малорастворима в этиловом спирте и диэтиловом эфире, хорошо растворяется в сероуглероде. Порошок серы плавает на поверхности воды, кристаллы серы тонут в воде | Прозрачная резинообразная масса темно-коричневого цвета, вытягивается в эластичные нити |
| Возможные переходы в другую модификацию | Переходит в пластическую серу при нагревании | Через несколько дней превращается в ромбическую серу |
По окончании работы проводится фронтальная проверка в виде устного опроса учащихся, которые дают характеристику ромбической и пластической серы, используя таблицу.
В связи с сокращением количества времени, отводимого на изучение курса неорганической химии в 9-м классе, проблема ознакомления учащихся с основами местных химических производств может быть решена за счет школьного или регионального компонента. В предлагаемом далее примере используется проблемное обучение [см. 1], дополняющее исследовательский метод.
Градообразующее предприятие нашего города – ОАО «Североникель». Среди товарной продукции предприятия – высококачественная серная кислота. По моему убеждению, учащиеся, большинство которых будет работать на комбинате, должны понимать элементарные основы технологического процесса, происходящего при производстве продукции. Поэтому я не исключаю тему «Производство серной кислоты» из содержания курса.
Актуализация знаний, мотивация происходит в начале работы: демонстрируются образцы местной и норильской руд, среди особенностей последней отмечается высокое содержание серы. Учащимся напоминается знакомая с детства картина – периодические выбросы в атмосферу сернистого газа. Защита окрестностей от поражения сернистым газом в первую очередь решается расширением серно-кислотного производства, эффективно утилизирующим основную массу серы из газов металлургических печей.
В ходе работы используются материалы учебного пособия, демонстрационная таблица «Производство серной кислоты контактным способом» и дополнительная информация регионального содержания. В результате работы над этой темой составляется упрощенная схема технологического процесса производства серной кислоты, сопровождаемая соответствующими уравнениями реакций.
Для учащихся это исследование актуально, оно касается решения жизненно важной проблемы.
Использование в учебном процессе практических работ исследовательского характера способствует активизации познавательного интереса учащихся, расширяет возможности для индивидуального и дифференцированного подхода к обучению, повышает творческую активность. Современная программа курса химии О.С.Габриеляна позволяет проводить практические работы исследовательской направленности начиная с 8-го класса: «Наблюдения за горящей свечой», «Анализ почвы и воды» . Для 9-го класса приводятся практические работы «Решение экспериментальных задач на распознавание важнейших катионов и анионов», «Практическое осуществление превращений веществ», «Решение экспериментальных задач на распознавание органических веществ» [см. 4].
В старших классах исследовательский характер практических работ усложняется: «Идентификация органических соединений», «Обнаружение витаминов», «Действие ферментов на различные вещества» – в 10-м классе ; «Получение, собирание и распознавание газов и изучение их свойств», «Сравнение свойств неорганических и органических соединений», «Решение экспериментальных задач по теме “Гидролиз” – в 11-м классе . При этом лабораторные и практические работы проводятся в течение изучения темы или сразу по ее окончании, по «свежим следам». Это позволяет поддерживать интерес к изучаемому материалу.
П рименяя исследовательский метод обучения на уроке, мы можем быть уверены, что некоторые учащиеся, обладающие оригинальным и гибким мышлением, выразят желание заняться исследовательскими проектами и во внеурочное время. На этом этапе важнейшее значение имеет выбор темы. Опыт показывает, что подростка интересует прежде всего то, что связано с его жизнью, здоровьем, бытом.
Так появилась на свет исследовательская работа «Дело вкуса», в которой учащиеся 9-го класса изучали влияние возраста, физических, психологических нагрузок, пола и вредных привычек на формирование вкуса. Измеряя абсолютные вкусовые пороги подростков в возрасте 14, 16–17 лет, а также взрослых людей в возрасте 40–60 лет, юные исследователи пришли к следующим выводам:
Девушки и юноши имеют разные вкусовые пороги на различные вкусовые ощущения (оказывается, юноши – настоящие сладкоежки);
С возрастом вкусовые пороги меняются;
Значительные и систематические физические нагрузки требуют дополнительной энергии, спортсмены становятся выраженными сладкоежками поневоле;
Интеллектуальная работа требует не меньших затрат энергии, чем физическая, и приводит к повышению потребности организма в дополнительном поступлении «быстрых» углеводов и, как следствие, повышению абсолютного вкусового порога;
Курение негативно влияет не только на дыхательную систему, но и на полноту вкусовых ощущений человека;
Существуют способы диагностирования различных заболеваний по расстройствам вкуса.
В заключение ребята обобщают: человек есть не только то, что он ест , но и какой образ жизни ведет, дает ли он возможность своему телу развиваться в соответствии с заложенным генотипом и совершенствоваться в соответствии с общечеловеческими понятиями о пользе и красоте.
Е сть еще одно направление исследовательской работы, неизменно вызывающее интерес учащихся, – экология и охрана окружающей среды. На протяжении нескольких лет я координирую исследовательские работы учащихся нашей школы по экологическому мониторингу г. Мончегорска.
Исследование «Голубая лагуна для жемчужины
Заполярья» (2002) посвящено проблемам загрязнения
водоемов на территории города. В работе
«Экологические ловушки» (2004) изучен уровень
загрязненности воздуха вблизи наиболее
загруженных участков автодорог Мончегорска. Она
является компактной, статистически выверенной
работой бывших учащихся 11-го класса Глафиры
Рыжковой и Натальи Семеновой, ныне студенток
Санкт-Петербургского химико-технологического
университета. В процессе исследования учащиеся
сделали вывод, что некоторые районы города
являются местами, где многократно превышаются
ПДK угарного газа, т.е. настоящими
«экологическими ловушками».
В ходе выполнения этой работы авторы активно
сотрудничали с работниками мончегорской ГИБДД,
принимали участие в ежегодной операции «Чистый
воздух» по выявлению чадящих автомобилей.
Весной 2006 г. учащимися 9-го класса была завершена работа «Мониторинг состояния снежного покрова», посвященная исследованиям уровня загрязненности снежного покрова некоторых наиболее населенных районов Мончегорска. Авторы работы пришли к интересным выводам:
Основным загрязнителем снежного покрова на территории города можно считать не комбинат «Североникель», а дворы обычных многоэтажных домов с их дымящимися, часто неопрятными мусорными контейнерами и чадящими автомобилями, чьи хозяева не соблюдают правила парковок; это приводит к дополнительному закислению снежного покрова и увеличению содержания твердых частиц в пробах снега;
С переходом комбината «Североникель» на новые технологии (переход от пирометаллургических к гидрометаллургическим способам получения металлов) роль его как стационарного источника выбросов уменьшилась, показатели проб, взятых у проходной комбината, по кислотности и содержанию твердого осадка не превышали показатели проб из других мест забора (за исключением территории городского парка);
Тревожные факты повышенной кислотности проб снега, взятых в районе перекрестка автомобильных дорог, говорят о том, что на наших дорогах по-прежнему много автотранспорта, работающего без применения каталитических нейтрализаторов, снижающих токсичность выхлопных газов;
Слабое закисление проб снега, взятых в районе городского парка, говорит о том, что он тоже не является идеально чистой территорией с точки зрения экологии.
Kроме того, юные исследователи поняли, что экологическое благополучие наших городов во многом зависит от корректного решения простых бытовых и житейских проблем: содержать в порядке свои дворы, правильно парковать автомобиль, вовремя его отремонтировать, не оставлять мусор после ремонта или строительства.
«Мы готовы сотрудничать с городским экологическим центром по проведению экологического мониторинга нашего города, можем предоставить результаты нашей работы для осуществления экологического воспитания на классных часах. Нам очень хочется, чтобы заснеженный Мончегорск был похож на зимнюю сказку», – пишут авторы в заключительной части работы.
Специалисты отмечают, что в современном стремительно меняющемся мире развитое исследовательское поведение можно рассматривать как неотъемлемую характеристику личности, как стиль жизни современного человека. Подготовка ребенка к исследовательской деятельности, обучение его умениям и навыкам исследовательского поиска становится важнейшей задачей современного образования.
Л и т е р а т у р а
1. Леднева С.А . Юный исследователь: обучение и развитие. Исследовательская работа школьников, 2004, № 1, с. 171–173.
2. Bolmgren I . Journal of Chemical Education, 1995, № 4, р. 337–338.
3. Артеменко А.А . Органическая химия. М.: Просвещение, 2001.
4. Габриелян О.С . Химия. 9 класс. М.: Дрофа, 2001.
5. Габриелян О.С . Химия. 8 класс. М.: Дрофа, 2001.
6. Габриелян О.С . и др . Химия. 10 класс. М.: Дрофа, 2001.
7. Габриелян О.С . и др . Химия. 11 класс. М.: Дрофа, 2001.
ОПРЕДЕЛЕНИЕ
Пластическая сера - это одна из аллотропных модификаций химического элемента серы, а именно ее существование в виде простого вещества в аморфном состоянии.
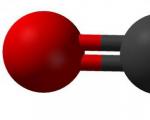
Пластическая сера представляет собой замкнутые или открытые цепи соединяющейся между собой серы. Это вещество коричневого цвета (рис. 1), получаемое при резком охлаждении расплава серы. Через несколько часов после получения пластическая сера становится хрупкой и приобретает желтый цвет постепенно превращаясь в ромбическую модификацию.
Рис. 1. Пластическая сера. Внешний вид.
Химическая формула пластической серы
Химическая формула пластической серы может иметь вид S 4 или S 6 . Она показывает, что в составе молекулы этого вещества находится четыре или шесть атомов серы (Ar = 32 а.е.м.). По химической формуле можно вычислить молекулярную массу пластической серы:
Mr(S 4) = 4×Ar(S) = 4×32 = 128;
Mr(S 6) = 6×Ar(S) = 6×32 = 192.
Структурная (графическая) формула пластической серы
Более наглядной является структурная (графическая) формула пластической серы. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула белого фосфора имеет вид:

Электронная формула
Электронная формула пластической серы показывает распределение электронов в атоме по энергетическим подуровням:
16 S 1s 2 2s 2 2p 6 3s 2 3p 4 .
Она также показывает, что сера относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 6 электронов (3s 2 3p 4).
Примеры решения задач
ПРИМЕР 1
| Задание | Найдите химическую формулу вещества, в состав которого входит 10 массовых частей кальция, 7 массовых частей азота и 24 массовых части кислорода. |
| Решение | Найдем молярные массы кальция азота и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Ca)= 40 г/моль, М(N) = 14 г/моль, а М(О) = 16 г/моль. n (Ca) = m (Ca) / M (Ca); n (Ca) = 10 / 40 = 0,25 моль. n (N) = m (N) / M (N); n (N) = 7 / 14 = 0,5 моль. n (O) = m (O) / M (O); n (O) = 24 / 16 = 1,5 моль. Найдем мольное отношение: n(Ca) :n(N): n (O) = 0,25: 0,5: 1,5= 1: 2: 6, т.е. формула соединения кальция азота и кислорода имеет вид CaN 2 O 6 или Ca(NO 3) 2 .Это нитрат кальция. |
| Ответ | Ca(NO 3) 2 |
ПРИМЕР 2
| Задание | В фосфиде кальция массой 3,62 г содержится 2,4 г кальция.Определите формулу этого соединения. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу:
Найдем молярные массы кальция и фосфора (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Ca)= 40 г/моль, а М(P) = 31 г/моль. Определим массу фосфора в составе фосфида кальция: m(P) = m (Ca x P y) - m(Ca); m(P) = 3,62 - 2,4 = 1,22 г. Тогда, количество вещества этих элементов равно: n (Ca) = m (Ca) / M (Ca); n (Ca) = 2,4 / 40 = 0,06 моль. n (P) = m (P) / M (P); n (P) = 1,22 / 31 = 0,04 моль. Найдем мольное отношение: n(Ca) :n(P)= 0,06: 0,04 = 1,5: 1 = 3: 2, т.е. формула фосфида кальция имеет вид Ca 3 P 2 . |
| Ответ | Ca 3 P 2 |