Только ковалентные связи имеет. Что такое ковалентная полярная и неполярная связь
Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
Характеристика ионной связи
 Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы , а наибольшими - типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет .
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na 0 - 1 е = Na + (катион)
Cl 0 + 1 е = Cl — (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba 0 - 2 е = Ba 2+
S 0 + 2 е = S 2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S 2- и катионы бария Ba 2+ .
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg - 2е <-> Mg 2+
Cs - e <-> Cs +
Ca - 2e <-> Ca 2+
Fe - 3e <-> Fe 3+
Ковалентная: полярная и неполярная
 Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого — свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
- простые или одинарные;
- двойные;
- тройные.
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные — трёх.
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
- неполярную;
- полярную.
Неполярную связь образуют одинаковые атомы, а полярную - разные по электроотрицательности.
 Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном — отрицательный заряд, а на менее — положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:
- Длина определяется расстоянием между ядрами взаимодействующих атомов.
- Полярность определяется смещением электронного облака к одному из атомов.
- Направленность - свойство образовывать ориентированные в пространстве связи и, соответственно, молекулы, имеющие определённые геометрические формы.
- Насыщаемость определяется способностью образовывать ограниченное число связей.
- Поляризуемость определяется способностью изменять полярность под действием внешнего электрического поля.
- Энергия необходимая для разрушения связи, определяющая её прочность.
 Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
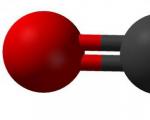
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (H2S), соляной кислоты (HCL), воды (H2O), метана (CH4) , оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами — ионную, простые вещества неметаллы — ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.
Единой теории химической связи не существует, условно химическую связь делят на ковалентную (универсальный вид связи), ионную(частный случай ковалентной связи), металлическую и водородную.
Ковалентная связь
Образование ковалентной связи возможно по трем механизмам: обменному, донорно-акцепторному и дативному (Льюиса).
Согласно обменному механизму образование ковалентной связи происходит за счет обобществления общих электронных пар. При этом каждый атом стремится приобрести оболочку инертного газа, т.е. получить завершенный внешний энергетический уровень. Образование химической связи по обменному типу изображают с использованием формул Льюиса, в которых каждый валентный электрон атома изображают точками (рис. 1).
Рис. 1 Образование ковалентной связи в молекуле HCl по обменному механизму
С развитием теории строения атома и квантовой механики образование ковалентной связи представляют, как перекрывание электронных орбиталей (рис. 2).

Рис. 2. Образование ковалентной связи за счет перекрывания электронных облаков
Чем больше перекрывание атомных орбиталей, тем прочнее связь, меньше длина связи и больше ее энергия. Ковалентная связь может образовываться за счет перекрывания разных орбиталей. В результате перекрывания s-s, s-p орбиталей, а также d-d, p-p, d-p орбиталей боковыми лопастями происходит образование – связи. Перпендикулярно линии, связывающей ядра 2-х атомов образуется – связь. Одна – и одна – связь способны образовывать кратную (двойную) ковалентную связь, характерную для органических веществ класса алкенов, алкадиенов и др. Одна – и две – связи образуют кратную (тройную) ковалентную связь, характерную для органических веществ класса алкинов (ацетиленов).
Образование ковалентной связи по донорно-акцепторному механизму рассмотрим на примере катиона аммония:
NH 3 + H + = NH 4 +
7 N 1s 2 2s 2 2p 3

Атом азота имеет свободную неподеленную пару электронов (электроны не участвующие в образовании химических связей внутри молекулы), а катион водорода свободную орбиталь, поэтому они являются донором и акцептором электронов, соответственно.
Дативный механизм образования ковалентной связи рассмотрим на примере молекулы хлора.
17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5

Атом хлора имеет и свободную неподеленную пару электронов и вакантные орбитали, следовательно, может проявлять свойства и донора и акцептора. Поэтому при образовании молекулы хлора, один атом хлора выступает в роли донора, а другой – акцептора.
Главными характеристиками ковалентной связи являются: насыщаемость (насыщенные связи образуются тогда, когда атом присоединяет к себе столько электронов, сколько ему позволяют его валентные возможности; ненасыщенные связи образуются, когда число присоединенных электронов меньше валентных возможностей атома); направленность (эта величина связана с геометрий молекулы и понятием «валентного угла» — угла между связями).
Ионная связь
Соединений с чистой ионной связью не бывает, хотя под этим понимают такое химически связанное состояние атомов, в котором устойчивое электронное окружение атома создается при полном переходе общей электронной плотности к атому более электроотрицательного элемента. Ионная связь возможна только между атомами электроотрицательных и электроположительных элементов, находящихся в состоянии разноименно заряженных ионов – катионов и анионов.
ОПРЕДЕЛЕНИЕ
Ионом называют электрически заряженные частицы, образуемые путем отрыва или присоединения электрона к атому.
При передаче электрона атомы металлов и неметаллов стремятся сформировать вокруг своего ядра устойчивую конфигурацию электронной оболочки. Атом неметалла создает вокруг своего ядра оболочку последующего инертного газа, а атом металла – предыдущего инертного газа (рис. 3).

Рис. 3. Образование ионной связи на примере молекулы хлорида натрия
Молекулы, в которых в чистом виде существует ионная связь встречаются в парообразном состоянии вещества. Ионная связь очень прочная, в связи с этим вещества с этой связью имеют высокую температуру плавления. В отличии от ковалентной для ионной связи не характерны направленность и насыщаемость, поскольку электрическое поле, создаваемое ионами, действует одинаково на все ионы за счет сферической симметрии.
Металлическая связью
Металлическая связь реализуется только в металлах – это взаимодействие, удерживающее атомы металлов в единой решетке. В образовании связи участвуют только валентные электроны атомов металла, принадлежащие всему его объему. В металлах от атомов постоянно отрываются электроны, которые перемещаются по всей массе металла. Атомы металла, лишенные электронов, превращаются в положительно заряженные ионы, которые стремятся принять к себе движущиеся электроны. Этот непрерывный процесс формирует внутри металла так называемый «электронный газ», который прочно связывает между собой все атомы металла (рис. 4).
Металлическая связь прочная, поэтому для металлов характерна высокая температура плавления, а наличие «электронного газа» придают металлам ковкость и пластичность.
Водородная связь
Водородная связь – это специфическое межмолекулярное взаимодействие, т.к. ее возникновение и прочность зависят от химической природы вещества. Она образуется между молекулами, в которых атом водорода связан с атомом, обладающим высокой электроотрицательностью (O, N, S). Возникновение водородной связи зависит от двух причин, во-первых, атом водорода, связанный с электроотрицательным атомом не имеет электронов и может легко внедряться в электронные облака других атомов, а, во-вторых, обладая валентной s-орбиталью, атом водорода способен принимать неподеленную пару электронов электроотрицательного атома и образовывать с ним связь по донорно акцепторному механизму.
Ковалентная связь — самый распространенный тип химической связи, осуществляемой при взаимодействии с одинаковыми или близкими значениями электроотрицательности.
Ковалентная связь — это связь атомов с помощью общих электронных пар.
После открытия электрона проводилось много попыток разработать электронную теорию химической связи. Наиболее удачными стали работы Льюиса (1916 г.), который предложил рассматривать образование связи как следствие возникновения общих для двух атомов электронных пар. Для этого каждый атом предоставляет одинаковое количество электронов и пытается окружить себя октетом или дублетом электронов, характерным для внешней электронной конфигурации инертных газов. Графически образования ковалентных связей за счет неспаренных электронов по методу Льюиса изображают с помощью точек, обозначающих внешние электроны атома.
Образование ковалентной связи согласно теории Льюиса
Механизм образования ковалентной связи
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных.
по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:
 Общая схема образования ковалентной связи: а) по обменному механизму; б) по донорно-акцепторному механизму
Общая схема образования ковалентной связи: а) по обменному механизму; б) по донорно-акцепторному механизму
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.
Частица, которая предоставляет для связи двухэлектронное (неразделенную пару электронов), называется донором, а частица со свободной орбиталью, которая принимает эту электронную пару, — акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и вакантной орбитали другого называется донорно-акцепторным механизмом.
Донорно-акцепторный связь иначе называется семиполярной, поскольку на атоме-доноре возникает частичный эффективный положительный заряд δ+ (за счет того, что его неразделенная пара электронов отклонилась от него), а на атоме-акцепторе — частичный эффективный отрицательный заряд δ- (благодаря тому, что происходит смещение в его сторону неразделенной электронной пары донора).
В качестве примера простого донора электронной пары можно привести ион Н — , который имеет неразделенную электронную пару. В результате присоединения негативного гидрид-иона к молекуле, центральный атом которой имеет свободную орбиталь (на схеме обозначена как пустая квантовая ячейка), например ВН 3 , образуется сложный комплексный ион ВН 4 — с отрицательным зарядом (Н — + ВН 3 ⟶⟶ [ВН 4 ] —) :

Акцептор электронной пары — ион водорода, или просто протон Н + . Его присоединение к молекуле, центральный атом которой имеет неразделенную электронную пару, например к NH 3 , тоже приводит к образованию комплексного иона NH 4 + , но уже с положительным зарядом:

Метод валентных связей
Первая квантово-механическая теория ковалентной связи была создана Гейтлером и Лондоном (в 1927 г.) для описания молекулы водорода, а затем была применена Полингом к многоатомным молекулам. Эта теория называется методом валентных связей , основные положения которого кратко можно изложить так:
- каждая пара атомов в молекуле содержится вместе с помощью одной или нескольких общих электронных пар, при этом электронные орбитали взаимодействующих атомов перекрываются;
- прочность связи зависит от степени перекрывания электронных орбиталей;
- условием образования ковалентной связи является антинаправленность спинов электронов; благодаря этому возникает обобщенная электронная орбиталь с наибольшей электронной плотностью в межъядерном пространстве, которая обеспечивает притяжение положительно заряженных ядер друг к другу и сопровождается уменьшением общей энергии системы.
Гибридизация атомных орбиталей
Несмотря на то, что в образовании ковалентных связей участвуют электроны s-, p- или d-орбиталей, имеющие различные форму и различную ориентацию в пространстве, во многих соединениях эти связи оказываются равноценными. Для объяснения этого явления было введено понятие «гибридизация».
Гибридизация — это процесс смешивания и выравнивания орбиталей по форме и энергии, при котором происходит перераспределение электронных плотностей близких по энергии орбиталей, в результате чего они становятся равноценными.
Основные положения теории гибридизации:
- При гибридизации начальная форма и орбиталей взаимно меняются, при этом образуются новые, гибридизованные орбитали, но уже с одинаковой энергией и одинаковой формы, напоминающей неправильную восьмерку.
- Число гибридизованных орбиталей равно числу выходных орбиталей, участвующих в гибридизации.
- В гибридизации могут участвовать орбитали с близкими по значениям энергиями (s- и p-орбитали внешнего энергетического уровня и d-орбитали внешнего или предварительного уровней).
- Гибридизованные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрытие с орбиталями соседнего атома, вследствие этого становится более прочным, чем образованный за счет электронов отдельных негибридных орбиталей.
- Благодаря образованию более прочных связей и более симметричном распределения электронной плотности в молекуле получается энергетический выигрыш, который с запасом компенсирует расход энергии, необходимой для процесса гибридизации.
- Гибридизованные орбитали должны ориентироваться в пространстве таким образом, чтобы обеспечить взаимное максимальное отдаление друг от друга; в этом случае энергия отталкивания наименьшая.
- Тип гибридизации определяется типом и количеством выходных орбиталей и меняет размер валентного угла, а также пространственную конфигурацию молекул.
 Форма гибридизованных орбиталей и валентных углы (геометрические углы между осями симметрии орбиталей) в зависимости от типа гибридизации: а) sp-гибридизация; б) sp 2 -гибридизация; в) sp 3 -гибридизация
Форма гибридизованных орбиталей и валентных углы (геометрические углы между осями симметрии орбиталей) в зависимости от типа гибридизации: а) sp-гибридизация; б) sp 2 -гибридизация; в) sp 3 -гибридизация
При образовании молекул (или отдельных фрагментов молекул) чаще всего встречаются такие типы гибридизации:
 Общая схема sp-гибридизации
Общая схема sp-гибридизации
Связи, которые образуются с участием электронов sp-гибридизованнных орбиталей, также размещаются под углом 180 0 , что приводит к линейной форме молекулы. Такой тип гибридизации наблюдается в галогенидах элементов второй группы (Be, Zn, Cd, Hg), атомы которых в валентном состоянии имеют неспаренные s- и р-электроны. Линейная форма характерна и для молекул других элементов (0=C=0,HC≡CH), в которых связи образуются sp-гибридизованными атомами.
 Схема sp 2 -гибридизации атомных орбиталей и плоская треугольная форма молекулы, которая обусловлена sp 2 -гибридизацией атомных орбиталей
Схема sp 2 -гибридизации атомных орбиталей и плоская треугольная форма молекулы, которая обусловлена sp 2 -гибридизацией атомных орбиталей
Этот тип гибридизации наиболее характерен для молекул р-элементов третьей группы, атомы которых в возбужденном состоянии имеют внешнюю электронную структуру ns 1 np 2 , где n — номер периода, в котором находится элемент. Так, в молекулах ВF 3 , BCl 3 , AlF 3 и в других связи образованы за счет sp 2 -гибридизованных орбиталей центрального атома.
 Схема sp 3 -гибридизации атомных орбиталей
Схема sp 3 -гибридизации атомных орбиталей
Размещение гибридизованных орбиталей центрального атома под углом 109 0 28` вызывает тетраэдрическую форму молекул. Это очень характерно для насыщенных соединений четырехвалентного углерода СН 4 , СCl 4 , C 2 H 6 и других алканов. Примерами соединений других элементов с тетраэдрической строением вследствие sp 3 -гибридизации валентных орбиталей центрального атома является ионы: BН 4 — , BF 4 — , PO 4 3- , SO 4 2- , FeCl 4 — .
 Общая схема sp 3d -гибридизации
Общая схема sp 3d -гибридизации
Этот тип гибридизации чаще всего встречается в галогенидах неметаллов. В качестве примера можно привести строение хлорида фосфора PCl 5 , при образовании которого атом фосфора (P … 3s 2 3p 3) сначала переходит в возбужденное состояние (P … 3s 1 3p 3 3d 1), а затем подвергается s 1 p 3 d- гибридизации — пять одноэлектронных орбиталей становятся равноценными и ориентируются вытянутыми концами к углам мысленной тригональной бипирамиды. Это и определяет форму молекулы PCl 5 , которая образуется при перекрытии пяти s 1 p 3 d- гибридизованных орбиталей с 3р-орбиталями пяти атомов хлора.
- sp — Гибридизация. При комбинации одной s- i одной р-орбиталей возникают две sp-гибридизованные орбитали, расположенные симметрично под углом 180 0 .
- sp 2 — Гибридизация. Комбинация одной s- и двух р-орбиталей приводит к образованию sp 2 -гибридизованных связей, расположенных под углом 120 0 , поэтому молекула приобретает форму правильного треугольника.
- sp 3 — Гибридизация. Комбинация четырех орбиталей — одной s- и трех р приводит к sp 3 — гибридизации, при которой четыре гибридизованные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, то есть под углом 109 0 28 `.
- sp 3 d — Гибридизация. Комбинация одной s-, трех р- и одной d- орбиталей дает sp 3 d- гибридизацию, что определяет пространственную ориентацию пяти sp 3 d-гибридизованных орбиталей к вершинам тригональной бипирамиды.
- Другие типы гибридизации. В случае sp 3 d 2 -гибридизации шесть sp 3 d 2 -гибридизованных орбиталей направлены к вершинам октаэдра. Ориентация семи орбиталей к вершинам пентагональной бипирамиды соответствует sp 3 d 3 -гибридизации (или иногда sp 3 d 2 f) валентных орбиталей центрального атома молекулы или комплекса.
Метод гибридизации атомных орбиталей объясняет геометрическую структуру большого количества молекул, однако согласно опытным данным чаще наблюдаются молекулы с несколько другими значениями валентных углов. Например, в молекулах СН 4 , NH 3 и Н 2 О центральные атомы находятся в sp 3 -гибридизованном состоянии, поэтому можно было бы ожидать, что валентные углы в них равны тетраэдрическим (~ 109,5 0). Экспериментально установлено, что валентный угол в молекуле СН 4 на самом деле составляет 109,5 0 . Однако в молекулах NH 3 и Н 2 O значение валентного угла отклоняется от тетраэдрического: он равен 107,3 0 в молекуле NH 3 и 104,5 0 в молекуле Н 2 О. Такие отклонения объясняется наличием неразделенной электронной пары у атомов азота и кислорода. Двухэлектронная орбиталь, которая содержит неразделенную пару электронов, благодаря повышенной плотности отталкивает одноэлектронные валентные орбитали, что приводит к уменьшению валентного угла. У атома азота в молекуле NH 3 из четырех sp 3 -гибридизованных орбиталей три одноэлектронные орбитали образуют связи с тремя атомами Н, а на четвертой орбитали содержится неразделенная пара электронов.
Несвязанная электронная пара, которая занимает одну из sp 3 -гибридизованных орбиталей, направленных к вершинам тетраэдра, отталкивая одноэлектронные орбитали, вызывает асимметричное распределение электронной плотности, окружающей атом азота, и как следствие сжимает валентный угол до 107,3 0 . Аналогичная картина уменьшения валентного угла от 109,5 0 до 107 0 в результате воздействия неразделенной электронной пары атома N наблюдается и в молекуле NCl 3 .
 Отклонение валентного угла от тетраэдрического (109,5 0) в молекуле: а) NН3 ; б) NCl3
Отклонение валентного угла от тетраэдрического (109,5 0) в молекуле: а) NН3 ; б) NCl3
У атома кислорода в молекуле Н 2 О на четыре sp 3 -гибридизованные орбитали приходится по две одноэлектронные и две двухэлектронные орбитали. Одноэлектронные гибридизованные орбитали участвуют в образовании двух связей с двумя атомами Н, а две двухэлектронные пары остаются неразделенными, то есть принадлежащими только атому H. Это увеличивает асимметричность распределения электронной плотности вокруг атома О и уменьшает валентный угол по сравнению с тетраэдрическим до 104.5 0 .
Следовательно, число несвязанных электронных пар центрального атома и их размещения на гибридизованных орбиталях влияет на геометрическую конфигурацию молекул.
Характеристики ковалентной связи
Ковалентная связь имеет набор определенных свойств, которые определяют ее специфические особенности, или характеристики. К ним, кроме уже рассмотренных характеристик «энергия связи» и «длина связи», относятся: валентный угол, насыщенность, направленность, полярность и тому подобное.
1. Валентный угол — это угол между соседними осями связей (то есть условными линиями, проведенными через ядра химически соединенных атомов в молекуле). Величина валентного угла зависит от природы орбиталей, типа гибридизации центрального атома, влияния неразделенных электронных пар, которые не участвуют в образовании связей.
2. Насыщенность . Атомы имеют возможности для образования ковалентных связей, которые могут формироваться, во-первых, по обменному механизму за счет неспаренных электронов невозбуждённого атома и за счет тех неспаренных электронов, которые возникают в результате его возбуждения, а во-вторых, по донорно акцепторному механизму. Однако общее количество связей, которые может образовывать атом, ограничено.
Насыщенность — это способность атома элемента образовывать с другими атомами определенное, ограниченное количество ковалентных связей.
Так, второго периода, которые имеют на внешнем энергетическом уровне четыре орбитали (одну s- и три р-), образуют связи, число которых не превышает четырех. Атомы элементов других периодов с большим числом орбиталей на внешнем уровне могут формировать больше связей.
3. Направленность . В соответствии с методом, химическая связь между атомами обусловлена перекрытием орбиталей, которые, за исключением s-орбиталей, имеют определенную ориентацию в пространстве, что и приводит к направленности ковалентной связи.
Направленность ковалентной связи — это такое размещение электронной плотности между атомами, которое определяется пространственной ориентацией валентных орбиталей и обеспечивает их максимальное перекрытие.
Поскольку электронные орбитали имеют различные формы и различную ориентацию в пространстве, то их взаимное перекрытие может реализоваться различными способами. В зависимости от этого различают σ-, π- и δ- связи.
Сигма-связь (σ-связь) — это такое перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется вдоль воображаемой линии, соединяющей два ядра.
Сигма-связь может образовываться за счет двух s-электронов, одного s- и одного р электрона, двух р-электронов или двух d-электронов. Такая σ-связь характеризуется наличием одной области перекрытия электронных орбиталей, она всегда одинарная, то есть образуется только одной электронной парой.

Разнообразие форм пространственной ориентации «чистых» орбиталей и гибридизованных орбиталей не всегда допускают возможность перекрывания орбиталей на оси связи. Перекрывания валентных орбиталей может происходить по обе стороны от оси связи — так называемое «боковое» перекрывания, которое чаще всего осуществляется при образовании π-связей.
Пи-связь (π-связь) — это перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется по обе стороны от линии, соединяющей ядра атомов (т.е. от оси связи).
Пи-связь может образоваться при взаимодействии двух параллельных р-орбиталей, двух d-орбиталей или других комбинаций орбиталей, оси которых не совпадают с осью связи.
 Схемы образования π-связей между условными А и В атомами при боковом перекрытии электронных орбиталей
Схемы образования π-связей между условными А и В атомами при боковом перекрытии электронных орбиталей
4. Кратность. Эта характеристика определяется числом общих электронных пар, связывающих атомы. Ковалентная связь по кратности может быть одинарной (простой), двойной и тройной. Связь между двумя атомами с помощью одной общей электронной пары называется одинарной связью (простой), двух электронных пар — двойной связью, трех электронных пар — тройной связью. Так, в молекуле водорода Н 2 атомы соединены одинарной связью (Н-Н), в молекуле кислорода О 2 — двойным (В = О), в молекуле азота N 2 — тройным (N≡N). Особое значение кратность связей приобретает в органических соединениях — углеводородах и их производных: в этане С 2 Н 6 между атомами С осуществляется одинарная связь (С-С), в этилене С 2 Н 4 — двойная (С = С) в ацетилене С 2 Н 2 — тройная (C ≡ C)(C≡C).
Кратность связи влияет на энергию: с повышением кратности растет ее прочность. Повышение кратности приводит к уменьшению межъядерного расстояния (длины связи) и увеличению энергии связи.
 Кратность связи между атомами углерода: а) одинарная σ-связь в этане Н3С-СН3 ; б) двойная σ+π-связь в этилене Н2С = СН2 ; в) тройная σ+π+π-связь в ацетилене HC≡CH
Кратность связи между атомами углерода: а) одинарная σ-связь в этане Н3С-СН3 ; б) двойная σ+π-связь в этилене Н2С = СН2 ; в) тройная σ+π+π-связь в ацетилене HC≡CH
5. Полярность и поляризуемость . Электронная плотность ковалентной связи может по-разному располагаться в межъядерном пространстве.
Полярность — это свойство ковалентной связи, которое определяется областью расположения электронной плотности в межъядерном пространстве относительно соединенных атомов.
В зависимости от размещения электронной плотности в межъядерном пространстве различают полярная и неполярная ковалентные связи. Неполярной связью называется такая связь, при которой общее электронное облако размещается симметрично относительно ядер соединенных атомов и одинаково принадлежит обоим атомам.
Молекулы с таким типом связи называются неполярными или гомоядерными (то есть такими, в состав которых входят атомы одного элемента). Неполярная связь проявляется как правило в гомоядерных молекулах (Н 2 , Cl 2 , N 2 и т.д.) или — реже — в соединениях, образованных атомами элементов с близкими значениями электроотрицательности, например, карборунд SiC. Полярной, (или гетерополярной) называется связь, при которой общее электронное облако несимметричное и смещено к одному из атомов.
Молекулы с полярной связью называются полярными, или гетероядерными. В молекулах с полярной связью обобщенная электронная пара смещается в сторону атома с большей электроотрицательностью. В результате на этом атоме возникает некоторый частичный отрицательный заряд (δ-), который называется эффективным, а у атома с меньшей электроотрицательностью — одинаковый по величине, но противоположный по знаку частичный положительный заряд (δ+). Например, экспериментально установлено, что эффективный заряд на атоме водорода в молекуле хлорида водорода HCl — δH=+0,17, а на атоме хлора δCl=-0,17 абсолютного заряда электрона.
Чтобы определить, в какую сторону будет смещаться электронная плотность полярной ковалентной связи, необходимо сравнить электроны обоих атомов. По возрастанию электроотрицательности наиболее распространенные химические элементы размещаются в такой последовательности:
Полярные молекулы называются диполями — системами, в которых центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают.
Диполь — это система, которая представляет собой совокупность двух точечных электрических зарядов, одинаковых по величине и противоположных по знаку, находящихся на некотором расстоянии друг от друга.
Расстояние между центрами притяжения называются длина диполя и обозначаются буквой l. Полярность молекулы (или связи) количественно характеризуется дипольным моментом μ, который в случае двухатомной молекулы равен произведению длины диполя на величину заряда электрона: μ=el.
В единицах СИ дипольный момент измеряется в [Кл × м] (Кулон-метры), но чаще пользуются внесистемной единицей [D] (дебай): 1D = 3,33 · 10 -30 Кл × м. Значение дипольных моментов ковалентных молекул меняется в пределах 0-4 D, а ионных — 4-11D. Чем больше длина диполя, тем более полярной является молекула.
Совместная электронное облако в молекуле может смещаться под действием внешнего электрического поля, в том числе и поля другой молекулы или иона.
Поляризуемость — это изменение полярности связи в результате смещения электронов, образующих связь, под действием внешнего электрического поля, в том числе и силового поля другой частицы.
Поляризуемость молекулы зависит от подвижности электронов, которая является тем сильнее, чем больше расстояние от ядер. Кроме того, поляризуемость зависит от направленности электрического поля и от способности электронных облаков деформироваться. Под действием внешнего поля неполярные молекулы становятся полярными, а полярные — еще более полярными, то есть в молекулах индуцируется диполь, который называется приведенным, или индуцированным диполем.
 Схема образования индуцированного (приведенного) диполя из неполярной молекулы под действием силового поля полярной частицы — диполя
Схема образования индуцированного (приведенного) диполя из неполярной молекулы под действием силового поля полярной частицы — диполя
В отличие от постоянных, индуцированные диполи возникают лишь при действии внешнего электрического поля. Поляризация может вызывать не только поляризуемость связи, но и ее разрыв, при котором происходит переход связующего электронной пары к одному из атомов и образуются отрицательно и положительно заряженные ионы.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Молекулярные соединения в обычных условиях могут находиться в различных агрегатных состояниях: в виде газов (CO 2 , NH 3 , CH 4 , Cl 2 , O 2 , NH 3), легколетучих жидкостей (Br 2 , H 2 O, C 2 H 5 OH) или твердых кристаллических веществ, большинство из которых даже при очень незначительном нагревании способны быстро плавиться и легко сублимироваться (S 8 , P 4 , I 2 , сахар С 12 Н 22 О 11 , «сухой лед» СО 2).
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl 4 и малополярном спирте.
Немолекулярные (атомные) вещества с ковалентными связями (алмаз, графит, кремний Si, кварц SiO 2 , карборунд SiC и другие) образуют чрезвычайно прочные кристаллы, за исключением графита, которого имеет слоистую структуру. Например, кристаллическая решетка алмаза — правильный трехмерный каркас, в котором каждый sр 3 -гибридизованный атом углерода соединен с четырьмя соседними атомами С σ-связями. По сути весь кристалл алмаза — это одна огромная и очень прочная молекула. Аналогичное строение имеют и кристаллы кремния Si, который широко применяется в радиоэлектронике и электронной технике. Если заменить половину атомов С в алмазе атомами Si, не нарушая каркасную структуру кристалла, то получим кристалл карборунда — карбида кремния SiC — очень твердого вещества, используемого в качестве абразивного материала. А если в кристаллической решетке кремния между каждыми двумя атомами Si вставить по атому О, то образуется кристаллическая структура кварца SiO 2 — тоже очень твердого вещества, разновидность которого также используют как абразивный материал.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
 Кристаллы алмаза, кремния, кварца
Кристаллы алмаза, кремния, кварца
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700 o С.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» — совместно и «vales» — имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.

Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор — свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.

Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и общественные электроны не принадлежат в равной степени двум атомам. Большую часть времени общественные электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там общественные электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Благодаря которой образуются молекулы неорганических и органических веществ. Химическая связь появляется при взаимодействии электрических полей, которые создаются ядрами и электронами атомов. Следовательно, образование ковалентной химической связи связано с электрической природой.
Что такое связь
Под этим термином подразумевают результат действия двух либо более атомов, которые приводят к формированию прочной многоатомной системы. Основные виды химической связи образуются при уменьшении энергии реагирующих атомов. В процессе формирования связи атомы стараются завершить свою электронную оболочку.
Виды связи
В химии выделяют несколько видов связи: ионной, ковалентной, металлической. Ковалентная химическая связь имеет две разновидности: полярная, неполярная.
Каков механизм ее создания? Ковалентная неполярная химическая связь образуется между атомами одинаковых неметаллов, имеющих одну электроотрицательность. При этом образуются общие электронные пары.

Неполярная связь
Среди примеров молекул, у которых ковалентная химическая связь неполярного вида, можно назвать галогены, водород, азот, кислород.
Впервые эта связь была обнаружена в 1916 году американским химиком Льюисом. Сначала им была выдвинута гипотеза, а подтверждена она была только после экспериментального подтверждения.
Ковалентная химическая связь связана с электроотрицательностью. У неметаллов она имеет высокое значение. В ходе химического взаимодействия атомов не всегда возможен перенос электронов от одного атома к другому, в результате осуществляется их объединение. Между атомами появляется подлинная ковалентная химическая связь. 8 класс обычной школьной программы предполагает детальное рассмотрение нескольких видов связи.
Вещества, имеющие данный вид связи, при нормальных условиях - жидкости, газы, а также твердые вещества, имеющие невысокую температуру плавления.

Типы ковалентной связи
Подробнее остановимся на данном вопросе. Какие выделяют типы химической связи? Ковалентная связь существует в обменном, донорно-акцепторном вариантах.
Первый тип характеризуется отдачей каждым атомом одного неспаренного электрона на образование общей электронной связи.
Электроны, объединяемые в общую связь, должны обладать противоположными спинами. В качестве примера подобного вида ковалентной связи можно рассмотреть водород. При сближении его атомов наблюдается проникновение их электронных облаков друг в друга, именуемое в науке перекрыванием электронных облаков. В результате увеличивается электронная плотность между ядрами, а энергия системы понижается.
При минимальном расстоянии ядра водорода отталкиваются, в итоге образуется некое оптимальное расстояние.
В случае донорно-акцепторного типа ковалентной связи у одной частицы есть электроны, ее называют донором. Вторая частица имеет свободную ячейку, в которой будет размещаться пара электронов.

Полярные молекулы
Как образуются ковалентные полярные химические связи? Они возникают в тех ситуациях, когда у связываемых атомов неметаллов различная электроотрицательность. В подобных случаях обобществленные электроны размещаются ближе к тому атому, у которого значение электроотрицательности выше. В качестве примера ковалентной полярной связи могут рассматриваться связи, которые возникают в молекуле бромоводорода. Здесь общественные электроны, которые отвечают за формирование ковалентной связи, ближе находятся к брому, чем к водороду. Причина подобного явления в том, что у брома электроотрицательность выше, чем у водорода.

Способы определения ковалентной связи
Как определить ковалентные полярные химические связи? Для этого необходимо знать состав молекул. Если в ней присутствуют атомы разных элементов, в молекуле существует ковалентная полярная связь. В неполярных молекулах присутствуют атомы одного химического элемента. Среди тех заданий, которые предлагаются в рамках школьного курса химии, есть и такие, которые предполагают выявление вида связи. Задания подобного типа включены в задания итоговой аттестации по химии в 9 классе, а также в тесты единого государственного экзамена по химии в 11 классе.
Ионная связь
Чем отличается ковалентная и ионная химическая связь? Если ковалентная связь характерна для неметаллов, то ионная связь образуется между атомами, имеющими существенные отличия по электроотрицательности. К примеру, это характерно для соединений элементов первой и второй групп главных подгрупп ПС (щелочных и щелочноземельных металлов) и элементов 6 и 7 групп главных подгрупп таблицы Менделеева (халькогенов и галогенов).
Она формируется в результате электростатического притяжения ионов, обладающих противоположными зарядами.

Особенности ионной связи
Так как силовые поля противоположно заряженных ионов распределяются равномерно во всех направлениях, каждый из них способен притягивать к себе противоположные по знаку частицы. Это и характеризует ненаправленность ионной связи.
Взаимодействие двух ионов, обладающих противоположными знаками, не предполагает полной взаимной компенсации индивидуальных силовых полей. Это способствует сохранению способности притягивать по остальным направлениям ионы, следовательно, наблюдается ненасыщенность ионной связи.
В ионном соединении у каждого иона есть возможность притягивать к себе некое число других, обладающих противоположных знаком, чтобы сформировать кристаллическую решетку ионного характера. В таком кристалле не существует молекул. Каждый ион окружается в веществе неким конкретным числом ионов иного знака.
Металлическая связь
Данный вид химической связи обладает определенными индивидуальными особенностями. Металлы имеют избыточное количество валентных орбиталей при недостатке электронов.
При сближении отдельных атомов происходит перекрывание их валентных орбиталей, что способствует свободному перемещению электронов из одной орбитали в другую, осуществляя между всеми атомами металла связь. Эти свободные электроны и являются основным признаком металлической связи. Она не обладает насыщенностью и направленностью, поскольку валентные электроны распределяются по кристаллу равномерно. Присутствие в металлах свободных электронов объясняет их некоторые физические свойства: металлический блеск, пластичность, ковкость, теплопроводность, непрозрачность.
Разновидность ковалентной связи
Она образуется между атомом водорода и элементом, который имеет высокую электроотрицательность. Существуют внутри- и межмолекулярные водородные связи. Эта разновидность ковалентной связи является самой непрочной, она появляется благодаря действию электростатических сил. У атома водорода небольшой радиус, и при смещении либо отдаче этого одного электрона водород становится положительным ионом, действующим на атом с большой электроотрицательностью.
Среди характерных свойств ковалентной связи выделяют: насыщаемость, направленность, поляризуемость, полярность. Каждый из этих показателей имеет определенное значение для образуемого соединения. К примеру, направленность обуславливается геометрической формой молекулы.